题目内容
15.氮化铝(AlN)是一种新型无机非金属材料.某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案.已知:AlN+NaOH+H2O═NaAlO2+NH3↑
【方案1】取一定量的样品,用图1装置测定样品中AlN的纯度(夹持装置已略去).
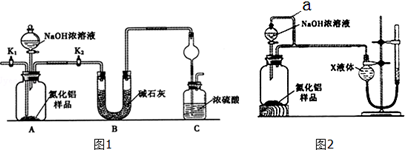
(1)图C装置中球形干燥管的作用是防止倒吸.
(2)完成以下实验步骤:组装好实验装置,首先检查装置气密性,再加入实验药品,接下来的实验操作是关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体.打开K1,通入氮气一段时间,测定C装置反应前后的质量变化.通入氮气的目的是把装置中残留的氨气全部赶入C装置.
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见C装置出口处连接一个干燥装置.
【方案2】用图2装置测定m g样品中A1N的纯度(部分夹持装置已略去).
(4)导管a的主要作用是保持气压恒定,使NaOH浓溶液容易流下.
(5)为测定生成气体的体积,量气装置中的X液体可以是ad(填选项序号).
a.CCl4 b.H2O c.NH4Cl溶液 d.
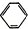
(6)若m g样品完全反应,测得生成气体的体积为VmL(已转换为标准状况),则AIN的质量分数是$\frac{41V}{22400m}$×100%(用含m、V的数学表达式表示).
【方案3】按图3步骤测定样品中A1N的纯度:

(7)步骤②生成沉淀的离子方程式为CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓.
(8)若在步骤③中未洗涤,测定结果将偏高(填“偏高”、“偏低”或“无影响”).
分析 (1)氨气是和浓硫酸能发生反应的气体,易发生倒吸;
(2)组装好实验装置,依据原理可知气体制备需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,反应生成氨气后卫把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算;
(3)装置存在缺陷是空气中的水蒸气和二氧化碳也可以进入装置C,使测定结果偏高,需要连接一个盛碱石灰干燥管;
(4)导管a的主要作用是保持压强不变,液体顺利流下;
(5)氨气极易溶于水,量气装置中的X液体不能与氨气反应,不能使氨气溶解;
(6)依据AIN+NaOH+H2O═NaAIO2+NH3↑在定量关系计算;
(7)步骤②生成的沉淀是氢氧化铝,是偏铝酸钠溶液中通入过量二氧化碳气体反应生成;
(8)沉淀不洗涤得到滤渣质量会增大,测定结果会偏高.
解答 解:(1)氨气是与浓硫酸能发生反应的气体,易发生倒吸,图C装置中球形干燥管的作用是防止倒吸的作用,
故答案为:防止倒吸;
(2)组装好实验装置,原理可知气体制备需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体.打开K1,通入氮气一段时间,测定C装置反应前后的质量变化.通入氮气的目的是,反应生成氨气后卫把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算,
故答案为:检查装置气密性;关闭K1,打开K2;把装置中残留的氨气全部赶入C装置;
(3)装置存在缺陷是空气中的水蒸气和二氧化碳也可以进入装置C,使测定结果偏高,需要连接一个盛碱石灰干燥管,
故答案为:C装置出口处连接一个干燥装置;
(4)装置图2中导管a的主要作用是保持气压恒定,使NaOH浓溶液容易流下,
故答案为:保持气压恒定,使NaOH浓溶液容易流下;
(5)a.CCl4不能溶解氨气,可以用排四氯化碳溶液的方法测定氨气体积,故a正确;
b.氨气极易溶于水,不能排水法测定,故b错误;
c.氨气极易溶于水,不能用排NH4Cl溶液的方法测定气体体积,故c错误;
d.氨气不溶于苯,可以利用排苯溶液,测定氨气的体积,故d正确,
故选ad;
(6)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),
AIN+NaOH+H2O═NaAIO2+NH3↑
41 22.4L
m V×10-3L
m=$\frac{41V×1{0}^{-3}}{22.4}$
则AlN的质量分数=$\frac{41V×1{0}^{-3}}{22.4m}$×100%=$\frac{41V}{22400m}$×100%,
故答案为:$\frac{41V}{22400m}$×100%;
(7)步骤②生成的沉淀是氢氧化铝,是偏铝酸钠溶液中通入过量二氧化碳气体反应生成,反应的离子方程式为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,
故答案为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓;
(8)若在步骤③中未洗涤,沉淀不洗涤得到滤渣质量会增大,测定结果会偏高,故答案为:偏高.
点评 本题考查了物质含量的测定探究实验设计和实验分析判断,把握实验基本操作和物质性质是解题关键,题目难度中等,注意把握实验原理以及各部操作的目的,侧重于考查学生的实验能力和计算能力.


| A. | 上述各物质中能发生水解反应的有A、B、D、G | |
| B. | 根据图示可推知D为苯酚 | |
| C. | A的结构中含有碳碳双键 | |
| D. | G的同分异构体中属于酯且能发生银镜反应的只有一种 |
| A. | 2.93 g | B. | 5.85 g | C. | 6.56g | D. | 无法确定 |
| A. | Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+HClO | |
| B. | 向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl- | |
| C. | NH4HCO3溶液和少量的NaOH溶液混合:HCO3-+OH-═CO32-+H2O | |
| D. | 向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I-=2Fe2++I2 |
| 试管 | CaCO3的状态 | 盐酸的浓度 | 温度 |
| A | 块状 | 1mol•L-1 | 20℃ |
| B | 粉末状 | 1mol•L-1 | 20℃ |
| C | 块状 | 2mol•L-1 | 40℃ |
| D | 粉末状 | 2mol•L-1 | 40℃ |
| A. | A | B. | B | C. | C | D. | D |
| A. | 紫外线 | B. | 福尔马林 | C. | 硫酸钠 | D. | 浓盐酸 |
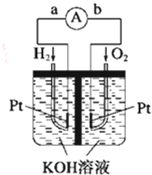 燃料电池是符合绿色化学理念的新型发电装置.如图为氢氧燃料电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
燃料电池是符合绿色化学理念的新型发电装置.如图为氢氧燃料电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答: (2)H2H:H(3)MgCl2
(2)H2H:H(3)MgCl2
 (5)CO2
(5)CO2 (6)Na2O
(6)Na2O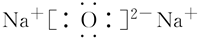
 ;O=C=O.
;O=C=O.