题目内容
4.甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应Ⅰ和Ⅱ来制备甲醇.请回答下列问题:(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L)中,在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)(Ⅰ)
CH4的转化率与温度、压强的关系如图1所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003mol•L-1•min-1.
②图中的p1<p2(填“<”、“>”或“=”),100℃时的平衡常数为2.25×10-4.
③该反应的△H>0,△S>0(填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:
CO(g)+2H2(g)?CH3OH△H<0 (Ⅱ)
①若容器的容积不变,下列措施可增大甲醇产率的是ABD(填序号).
A.降低温度
B.将CH3OH(g)从体系中分离出来
C.恒容下充入He,使体系的总压强增大
D.再充入a mol CO和3a mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了下面的实验设计表中.
| 实验编号 | T(℃) | n(CO)/n(H2) | P(MPa) |
| 1 | 180 | $\frac{2}{3}$ | 0.1 |
| 2 | n | $\frac{2}{3}$ | 5 |
| 3 | 350 | m | 5 |
b.根据反应Ⅱ的特点,如图是在压强分别为0.2MPa和5MPa下CO的转化率随温度变化的曲线,请指明图2中的压强px=0.2MPa.
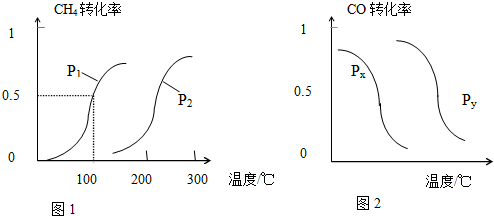
分析 (1)图1中100℃时甲烷的转化率为50%,则
CH4(g)+H2O(g)?CO(g)+3H2(g)
开始 0.01 0.02 0 0
转化 0.005 0.005 0.005 0.015
平衡 0.005 0.015 0.005 0.015
①结合v=$\frac{△c}{△t}$计算;
②相同温度时,压强越大,平衡逆向移动,转化率越小;K为生成物浓度幂之积与反应物浓度幂之积的比;
③该反应为气体的体积增大,且相同压强时温度越高、转化率越大;
(2)①可增大甲醇产率,应使平衡向正反应移动,结合该反应为放热反应、体积减小的反应判断;
②a.采取控制变量法,探究合成甲醇的温度和压强的适宜条件,据此判断m、n的值;
b.根据定一议二原则,定温度同,再比较压强,即作垂直x轴的辅助线,比较平衡时CO的转化率,由此判断.
解答 解:(1)图1中100℃时甲烷的转化率为50%,则
CH4(g)+H2O(g)?CO(g)+3H2(g)
开始 0.01 0.02 0 0
转化 0.005 0.005 0.005 0.015
平衡 0.005 0.015 0.005 0.015
①100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为v=$\frac{△c}{△t}$=$\frac{0.015mol/L}{5min}$=0.003mol•L-1•min-1,故答案为:0.003mol•L-1•min-1;
②相同温度时,压强越大,平衡逆向移动,转化率越小,则图中的p1<p2;100℃时的平衡常数K=$\frac{0.005×0.01{5}^{3}}{0.005×0.015}$=2.25×10-4,
故答案为:<;2.25×10-4;
③该反应为气体的体积增大,且相同压强时温度越高、转化率越大,正反应为吸热反应,则该反应的△H>0,△S>0,
故答案为:>;>;
(2)①A.该反应为放热反应,降低温度,平衡正向移动,甲醇的产率增大,故A正确;
B.将CH3OH(g)从体系中分离,产物的浓度降低,平衡向正反应移动,甲醇的产率增加,故B正确;
C.恒容下充入He,反应混合物各组分浓度不变,平衡不移动,甲醇的产率不变,故C错误;
D.再充入a mol CO和3a mol H2,可等效为压强增大,平衡向体积减小的方向移动,即向正反应方向移动,甲醇的产率增加,故D正确;
故答案为:ABD;
②a.采取控制变量法,探究合成甲醇的温度和压强的适宜条件,所以温度、压强是变化的,$\frac{n(CO)}{n({H}_{2})}$应保持不变,所以m=$\frac{2}{3}$;比较使用1、2,压强不同,所以温度应相同,故n=180,
故答案为:180;$\frac{2}{3}$;
b.温度相同时,作垂直x轴的辅助线,发现压强为Py对应CO的转化率高,反应为前后体积减小的反应,压强增大平衡向体积减小的方向移动,即向正反应移动,所以Px<Py,所以压强Px=0.2MPa,
故答案为:0.2.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、速率及K的计算、平衡移动、化学平衡图象为解答的关键,侧重分析与计算能力的考查,注意平衡移动原理的综合应用,题目难度不大.

 小题狂做系列答案
小题狂做系列答案| A. | 氢氧化钠是离子化合物,该物质中只存在离子键 | |
| B. | 干冰在升华的过程中,只需要克服分子间作用力 | |
| C. | 12 C与 13 C由于核外电子排布不同,所以属于同位素 | |
| D. | 在 N2、CO2 和 SiO2 三种物质中,都存在共价键,它们都是由分子构成的物质 |
| A. | SiCl4是分子晶体 | B. | 单质B是原子晶体 | C. | AlCl3是离子晶体 | D. | MgCl2离子晶体 |
| A. | 升高温度,H2S浓度增加,表明该反应的△H>0 | |
| B. | 随着反应的进行,混合气体的密度逐渐减小 | |
| C. | 反应前H2S物质的量为7mol | |
| D. | CO的平衡转化率为80% |