题目内容
9.将等物质的量的A、B两种物质混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L•min),求:(1)此时A的浓度c(A)=0.75mol/L及反应开始前放入容器中A、B的物质的量.n(A)=n(B)=3mol.
(2)X的值是多少?X=2
(3)B的平均反应速率.V(B)=0.05mol/(L•min).
(4)此时A的转化率为50%.
分析 (1)由D的浓度求出D的物质的量,根据方程式计算消耗A、B物质的量,再根据5min时A、B浓度之比列方程计算A与B的起始物质的量;
(2)反应中反应速率之比等于化学计量数之比求出x值;
(3)根据v=$\frac{△c}{△t}$计算v(B);
(4)转化率=$\frac{消耗量}{起始量}$×100%.
解答 解:(1)平衡时D的浓度为0.5mol/L,D的物质的量为2L×0.5mol/L=1mol,则:
3A(g)+B(g)=xC(g)+2D(g)
起始(mol):n n 0 0
变化(mol):1.5 0.5 0.5x 1
5min(mol):n-1.5 n-0.5 0.5x 1
所以(n-1.5):(n-0.5)=3:5,解得n=3,
5min时A的浓度为$\frac{1.5mol}{2L}$=0.75mol/L,
故答案为:0.75mol/L;3mol;
(2)反应速率之比等于化学计量数之比,所以v(B):v(C)=0.05 mol/(L.min):0.1mol/(L•min)=1:x,所以x=2,
故答案为:2.
(3)从开始到平衡时B的平均反应速率=$\frac{\frac{0.5mol}{2L}}{5min}$=0.05mol/(L•min),
故答案为:0.05mol/(L•min);
(4)此时A的转化率=$\frac{1.5mol}{3mol}$×100%=50%,
故意答案为:50%.
点评 本题考查化学反应速率、反应转化率、化学平衡有关计算,题目难度不大,注意对基础知识的理解掌握.

| A. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| B. | 蔗糖、淀粉、油脂及其水解产物均为非电解质 | |
| C. | 麦芽糖及其水解产物均能发生银镜反应 | |
| D. | 油脂在空气中完全燃烧转化为水和二氧化碳 |
| A. | ①②③④⑤⑥ | B. | ③④⑥⑦ | C. | ①②⑥⑦ | D. | ②③④⑤ |
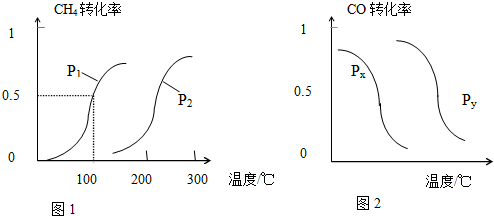
(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L)中,在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)(Ⅰ)
CH4的转化率与温度、压强的关系如图1所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003mol•L-1•min-1.
②图中的p1<p2(填“<”、“>”或“=”),100℃时的平衡常数为2.25×10-4.
③该反应的△H>0,△S>0(填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:
CO(g)+2H2(g)?CH3OH△H<0 (Ⅱ)
①若容器的容积不变,下列措施可增大甲醇产率的是ABD(填序号).
A.降低温度
B.将CH3OH(g)从体系中分离出来
C.恒容下充入He,使体系的总压强增大
D.再充入a mol CO和3a mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了下面的实验设计表中.
| 实验编号 | T(℃) | n(CO)/n(H2) | P(MPa) |
| 1 | 180 | $\frac{2}{3}$ | 0.1 |
| 2 | n | $\frac{2}{3}$ | 5 |
| 3 | 350 | m | 5 |
b.根据反应Ⅱ的特点,如图是在压强分别为0.2MPa和5MPa下CO的转化率随温度变化的曲线,请指明图2中的压强px=0.2MPa.
| 操作 | 现象 |
| 向盛有4.0g Na2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
| 向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
 它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.
它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.(2)甲同学认为ⅱ中溶液褪色是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应,并实验证实了H2O2的存在:取少量溶液a,加入试剂MnO2(填化学式),有气体产生.
(3)乙同学查阅资料获悉:用KMnO4可以氧化H2O2 并测定其含量.取20.00mL溶液,用稀H2SO4酸化,用0.002mol•L-1 KMnO4溶液滴定,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗10.00mL KMnO4溶液.
①实验中,滴定时KMnO4溶液应装在酸(酸或碱)式滴定管中.
②用单线桥标出该反应电子转移的方向和数目:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O.
③溶液a中c(H2O2)=0.0025mol•L-1.
④溶液褪色速率后阶段变快的原因可能是反应生成的Mn2+作催化剂.
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 蒸馏中,冷却水应从冷凝管的下口通入,上口流出 | |
| D. | 过滤操作时,漏斗颈下端不能紧靠烧杯内壁 |
| A. | 2W-+Z2═2Z-+W2 | B. | 2X-+Z2═2Z-+X2 | C. | 2Y-+W2═2W-+Y2 | D. | 2Z-+X2═2X-+Z2 |