题目内容
10.下列比较错误的是( )| A. | 金属性:Na>Mg>Al | B. | 非金属性:Cl>S>P>Si | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 酸性:HClO>H2SO3>H3PO4>H2SiO3 |
分析 A.同一周期中原子序数越大,金属性越弱;
B.同一周期的元素,原子序数越大,非金属性越强;
C.元素的金属性越强,最高价氧化物对应水合物的碱性越强;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,HClO不是Cl的最高价含氧酸.
解答 解:A.Na、Mg、Al位于第三周期,原子序数越大,金属性越弱,原子序数:Na<Mg<Al,则金属性:Na>Mg>Al,故A正确;
B.四种元素都位于第三周期,原子序数越大,非金属性越强,已知原子序数:Cl>S>P>Si,则非金属性:Cl>S>P>Si,故B正确;
C.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性Na>Mg>Al,则碱性NaOH>Mg(OH)2>Al(OH)3,故C正确;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>S>P>Si,则最高价含氧酸的酸性:HClO4>H2SO4>H3PO4>H2SiO3,由于HClO、H2SO3不是最高价含氧酸,无法据此判断酸性强弱,故D错误;
故选D.
点评 本题考查原子结构与元素周期律的关系,为高频考点,题目难度不大,明确非金属性、金属性与其氧化性、还原性强弱关系是解本题关键,注意总结归纳元素周期律并灵活运用,试题侧重考查学生分析判断及知识运用能力.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
1.用疏松多孔的活性炭插入KOH溶液作电极,在两极上分别通入甲烷和氧气,形成燃料电池,有关该电池的描述错误的是( )
| A. | 电池总反应:CH4+2O2+2OH-═CO32-+3H2O | |
| B. | 负极反应式:CH4-8e-+10OH-═CO32-+7H2O | |
| C. | 正极反应式:O2+4H++4e-═2H2O | |
| D. | CH4燃料电池比CH4直接燃烧能量利用率高 |
5.按钠、钾、铷、铯的顺序,下列有关叙述正确的是( )
| A. | 其氢氧化物中碱性最强的是NaOH | B. | 单质还原能力最强的是铯 | ||
| C. | 单质熔点最低的是钠 | D. | 原子半径逐渐减少 |
15.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 7.8g苯所含碳碳双键数目为0.3NA | |
| B. | 28g乙烯所含共用电子对数目为6NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含分子数为0.5NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为2NA |
2.硫酸铝铵[NH4Al(SO4)2]是一种重要的分析试剂,下列有关说法正确的是( )
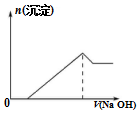

| A. | 硫酸铝铵中Al3+的水解程度比明矾中Al3+的水解程度大 | |
| B. | 该物质的水溶液中Na+、K+、Cl-、S2-都可大量共存 | |
| C. | 向该物质的溶液中滴加同浓度的NaOH溶液的体积与生成沉淀的关系如图所示 | |
| D. | 向该物质的溶液中滴加Ba(OH)2溶液,使SO42-恰好完全沉淀的离子方程式为:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O |
19.下列有关金属及金属材料的说法不正确的是( )
| A. | 合金的性能一般优于纯金属 | |
| B. | 碳素钢是目前用量最大的合金,碳素钢在空气中比纯铁耐腐蚀 | |
| C. | 酒精灯加热铝箔至熔化,铝并不滴落,说明铝表面生成一层致密的氧化膜 | |
| D. | 用金属铝与V2O5反应冶炼钒,主要是因为铝的还原能力比钒强 |
11.下列各组物质中的最简式相同.但既不是同系物也不是同分异构体的是( )
| A. | 丙烯、环己烯 | B. | 乙酸和甲酸甲酯 | ||
| C. | 对甲苯酚和苯甲醇 | D. | 甲醛和甲酸甲酯 |