题目内容
5.按钠、钾、铷、铯的顺序,下列有关叙述正确的是( )| A. | 其氢氧化物中碱性最强的是NaOH | B. | 单质还原能力最强的是铯 | ||
| C. | 单质熔点最低的是钠 | D. | 原子半径逐渐减少 |
分析 A.金属性越强,最高价氧化物对应水化物的酸性越强;
B.金属性越强,单质的还原性越强;
C.离子半径越大、离子电荷越小,金属键越弱,金属晶体的熔点越低;
D.同主族自上而下原子半径增大.
解答 解:A.同主族自上而下金属性增强,金属性越强,最高价氧化物对应水化物的酸性越强,故氢氧化物中碱性最弱的是NaOH,碱性最强的是CsOH,故A错误;
B.同主族自上而下金属性增强,金属性越强,单质的还原性越强,故单质还原能力最弱的是钠,单质还原能力最强的是铯,故B正确;
C.钠、钾、铷、铯的离子半径依次增大,金属键依次减弱,金属晶体的熔点依次降低,故C错误;
D.同主族自上而下原子电子层增多,原子半径增大,故D错误.
故选B.
点评 本题考查碱金属的性质,侧重对元素周期律的考查,从结构上理解同主族元素性质的递变规律,题目难度不大.

练习册系列答案
相关题目
15.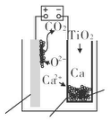 研究发现,可以用石墨作阳极、钛网作阴极、熔融的 CaF2-CaO 作电解质,利用如图 所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中,正确的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融的 CaF2-CaO 作电解质,利用如图 所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中,正确的是( )
 研究发现,可以用石墨作阳极、钛网作阴极、熔融的 CaF2-CaO 作电解质,利用如图 所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中,正确的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融的 CaF2-CaO 作电解质,利用如图 所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中,正确的是( )| A. | 由 TiO2 制得 1 mol 金属 Ti,理论上外电路通过 2 mol 电子 | |
| B. | 阳极的电极反应式为 C+2O2--4e-═CO2↑ | |
| C. | 在制备金属钛前后,整套装置中 CaO 的总量减少 | |
| D. | 若用铅蓄电池作该装置的供电电源,“+”接线柱应连接 Pb 电极 |
16.下列对晶体的描述不符合科学依据的是( )
| A. | NaCl晶体中Na+和Cl-之间存在离子键,使得其熔沸点较高 | |
| B. | 金刚石晶体中碳原子以共价键方式形成了立体网状结构,熔沸点高、硬度大 | |
| C. | 足球烯分子间存在分子间作用力,其笼状结构分子使得其具有独特的性能 | |
| D. | 金属钠属于金属晶体,能导电、传热,有延展性,硬度大 |
13.加拿大阿尔贡天文台在星际空间发现了HC9N链状分子,其结构为:HC≡C-C≡C-C≡C-C≡C-C≡N,这是人类迄今发现的最重星际有机分子,有关该分子的说法不正确的是( )
| A. | 该物质是有机物 | B. | 该分子中含有9个σ键和10个π键 | ||
| C. | 该分子可发生加成反应 | D. | 该分子中所有原子在同一直线上 |
20.将CO2气体通入下列溶液中,无明显现象的是( )
| A. | NaAlO2溶液 | B. | Na2SiO3溶液 | C. | 漂白粉溶液 | D. | CaCl2 |
10.下列比较错误的是( )
| A. | 金属性:Na>Mg>Al | B. | 非金属性:Cl>S>P>Si | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 酸性:HClO>H2SO3>H3PO4>H2SiO3 |
17.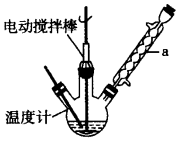 甲苯(
甲苯( 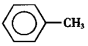 )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛( 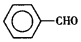 )、苯甲酸(
)、苯甲酸( 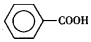 )等产品.表列出了有关物质的部分物理性质,请回答:
)等产品.表列出了有关物质的部分物理性质,请回答:
注:甲苯、苯甲醛、苯甲酸三者互溶.
实验室可用如图装置模拟制备苯甲醛.实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时.
(1)装置a的名称是冷凝管,主要作用是冷凝回流,防止甲苯的挥发而降低产品产率.
(2)三颈瓶中发生反应的化学方程式为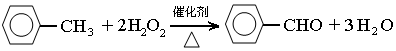
(3)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是H2O2在较高温度时分解速度加快,使实际参加反应的H2O2减少,影响产量.
(4)反应完毕后,反应混合液经过自然冷却至室温后,还应经过过滤、蒸馏(填操作名称)等操作,才能得到苯甲醛粗产品.
(5)实验中加入过量过氧化氢且反应时间较长,会使苯甲醛产品中产生较多的苯甲酸,若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是dacb(按步骤顺序填字母).
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.加入适量碳酸氢钠溶液混合震荡.
 甲苯(
甲苯(  )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(  )、苯甲酸(
)、苯甲酸(  )等产品.表列出了有关物质的部分物理性质,请回答:
)等产品.表列出了有关物质的部分物理性质,请回答:| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度(ρ水=1g/cm3) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
实验室可用如图装置模拟制备苯甲醛.实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时.
(1)装置a的名称是冷凝管,主要作用是冷凝回流,防止甲苯的挥发而降低产品产率.
(2)三颈瓶中发生反应的化学方程式为

(3)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是H2O2在较高温度时分解速度加快,使实际参加反应的H2O2减少,影响产量.
(4)反应完毕后,反应混合液经过自然冷却至室温后,还应经过过滤、蒸馏(填操作名称)等操作,才能得到苯甲醛粗产品.
(5)实验中加入过量过氧化氢且反应时间较长,会使苯甲醛产品中产生较多的苯甲酸,若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是dacb(按步骤顺序填字母).
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.加入适量碳酸氢钠溶液混合震荡.
6.①正丁烷 ②2-甲基丙烷 ③正戊烷 ④2-甲基丁烷 ⑤2,2-二甲基丙烷五种物质,以下说法正确的是( )
| A. | ①、③无支链,且分子中碳原子共直线 | B. | 沸点比较:⑤>④>③>②>① | ||
| C. | ①、②、③互为同系物 | D. | ③、④、⑤互为同分异构体 |
 某校化学兴趣小组拟探究碳、硅元素的非金属性的相对强弱,实验装置如图:
某校化学兴趣小组拟探究碳、硅元素的非金属性的相对强弱,实验装置如图: