题目内容
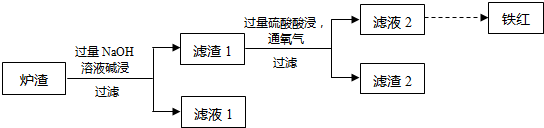
一定条件下,向某密闭容器中加入一定量的N2和H2发生可逆反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1,测得0到10秒内,c(H2)减小了0.75mol?L-1,下列说法正确的是( )
| A、10到15秒内c(NH3) 增加量等于0.25mol?L-1 |
| B、10秒内氨气的平均反应速率为0.025mol?L-1?s-1 |
| C、达平衡后,分离出少量NH3,v正增大 |
| D、该反应的逆反应的活化能不小于92.2kJ?mol-1 |
考点:化学平衡的计算,化学平衡的影响因素
专题:化学平衡专题
分析:A、随反应进行反应物的浓度减小,反应速率减小;
B、根据氢气的浓度变化求出氨气的浓度变化,再求反应速率;
C、减少生成物的浓度,反应速率减小
D、△H=正反应的活化能-逆反应的活化能;
B、根据氢气的浓度变化求出氨气的浓度变化,再求反应速率;
C、减少生成物的浓度,反应速率减小
D、△H=正反应的活化能-逆反应的活化能;
解答:
解:A、随反应进行反应物的浓度减小,反应速率减小,所以10s到15s内c(NH3)增加量小于0.25mol?L-1,故A错误;
B、测得0到10s内,c(H2)减小了0.75mol?L-1,则c(NH3)增加了0.5mol?L-1,所以10s内氨气的平均反应速率为:
=0.05mol?L-1?s-1,故B错误;
C、减少生成物的浓度,反应速率减小,则达平衡后,分离出少量NH3,平衡向正反应方向移动,v正减小,故C错误:
D、已知N2(g)+3H2(g)═2NH3(g)△H=-92.2kJ?mol-1,△H=正反应的活化能-逆反应的活化能=-92.2kJ?mol-1,则逆反应的活化能=正反应的活化能+92.2kJ?mol-1,所以逆反应的活化能不小于92.2kJ?mol-1,故D正确;
故选:D;
B、测得0到10s内,c(H2)减小了0.75mol?L-1,则c(NH3)增加了0.5mol?L-1,所以10s内氨气的平均反应速率为:
| 0.5mol/L |
| 10s |
C、减少生成物的浓度,反应速率减小,则达平衡后,分离出少量NH3,平衡向正反应方向移动,v正减小,故C错误:
D、已知N2(g)+3H2(g)═2NH3(g)△H=-92.2kJ?mol-1,△H=正反应的活化能-逆反应的活化能=-92.2kJ?mol-1,则逆反应的活化能=正反应的活化能+92.2kJ?mol-1,所以逆反应的活化能不小于92.2kJ?mol-1,故D正确;
故选:D;
点评:本题考查了反应速率的计算、影响平衡和速率的因素等,本题难度中等,试题涉及的知识点较多,注意掌握化学平衡的有关知识,题目难度中等.

练习册系列答案
相关题目
对于反应4HCl(浓)+MnO2
Cl2↑+MnCl2+2H2O,下列说法中不正确的是( )
| ||
| A、该反应是氧化还原反应 |
| B、MnO2是氧化剂 |
| C、HCl是还原剂 |
| D、HCl被还原 |
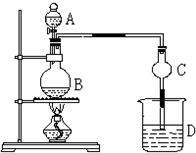 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸,D中放有饱和碳酸钠溶液.(已知:无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH)请回答下列问题:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸,D中放有饱和碳酸钠溶液.(已知:无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH)请回答下列问题: 已知甲酸(HCOOH)是羧酸中组成最简单的酸,它具有羧酸的性质,在实验室里常用甲酸在浓硫酸的作用下制取少量一氧化碳,现用甲酸与甲醇反应制取甲酸甲酯来验证甲酸具有能发生酯化反应的性质,装置如图所示
已知甲酸(HCOOH)是羧酸中组成最简单的酸,它具有羧酸的性质,在实验室里常用甲酸在浓硫酸的作用下制取少量一氧化碳,现用甲酸与甲醇反应制取甲酸甲酯来验证甲酸具有能发生酯化反应的性质,装置如图所示

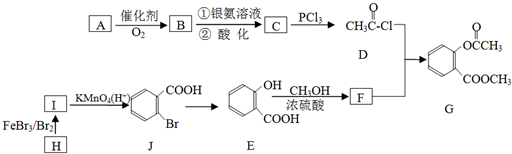
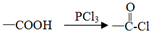
 结构
结构