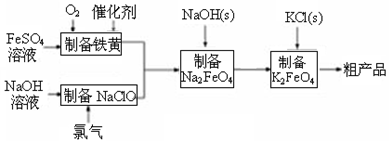
题目内容
19.短周期元素a、b,c、d、e在周期表中的位置如图,下列说法正确的是( )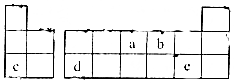
| A. | 气态氢化物的稳定性:a>b>c | |
| B. | 原子半径大小:a>b>c | |
| C. | c,d,e的氧化物对应的水化物之间两两皆能反应 | |
| D. | b、c形成的化合物中阴、阳离子的个数比为1:2 |
分析 由元素在周期表中的位置可知a为N、b为O、c为Na、d为Al、e为Cl元素.
A.元素的非金属性越强,对应的氢化物越稳定;
B.一般来说,原子核外电子层数越多,原子半径越大;
C.d为铝,对应的氧化物对应的水化物与强酸、强碱反应;
D.b、c形成的化合物可为Na2O、Na2O2.
解答 解:由元素在周期表中的位置可知a为N、b为O、c为Na、d为Al、e为Cl元素.
A.非金属性O>Cl>N元素的非金属性越强,对应的氢化物越稳定,故A错误;
B.一般来说,原子核外电子层数越多,原子半径越大,应为c>a>b,故B错误;
C.d为铝,对应的氧化物对应的水化物与强酸、强碱反应,如e对应的含氧酸为弱酸,与氢氧化铝不反应,故C错误;
D.b、c形成的化合物可为Na2O、Na2O2,化合物中阴、阳离子的个数比为1:2,故D正确.
故选D.
点评 本题考查位置、结构与性质的应用,为高频考点,把握元素的位置、元素化合物知识推断元素为解答的关键,侧重分析与推断能力的考查,注意元素周期律及元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
9.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向碳酸氢钙溶液中加入少量烧碱溶液:Ca2++2HCO3-+20H-═CaCO3↓+CO32-+H2O | |
| B. | 碘水中通入足量的 S02:I2+SO2+2H2O═2I-+S042-+4H+ | |
| C. | 向氯化铝溶液中滴加过量氨水:Al3++4NH3•H2O═A1O2-+4NH4++2H2O | |
| D. | 在强碱溶液中次氯酸钠与Fe(0H)3反应生成Na2FeO4:3ClO+2Fe(OH)3═2FeO32-+3Cl-+H2O+4H+ |
14.某中性有机物在酸性条件下可以水解生成相对分子质量相同的A和B,A是中性物质,B可以与碳酸钠反应放出气体,该有机物是( )
| A. | CH3COOC3H7 | B. | CH3COOC2H5 | C. | CH3COONa | D. | CH3CH2Br |
4.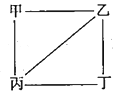 X、Y、Z、W为原子序数递增的4种短周周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如下图所示反应关系(图中“一”相连的两种物质能发生反应).下列判断正确的是( )
X、Y、Z、W为原子序数递增的4种短周周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如下图所示反应关系(图中“一”相连的两种物质能发生反应).下列判断正确的是( )
 X、Y、Z、W为原子序数递增的4种短周周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如下图所示反应关系(图中“一”相连的两种物质能发生反应).下列判断正确的是( )
X、Y、Z、W为原子序数递增的4种短周周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如下图所示反应关系(图中“一”相连的两种物质能发生反应).下列判断正确的是( )| A. | X是元素周期表中非金属性最强的元素 | |
| B. | Z位于元素周期表第3周期IA族 | |
| C. | 4种原子中,Y原子半径最小 | |
| D. | W的阴离子可能促进水的电离 |
11.能说明二氧化硫具有还原性的事实是( )
| A. | 使品红溶液褪色 | B. | 使溴水褪色 | C. | 与氢硫酸反应 | D. | 与烧碱反应 |
19.某混合物的水溶液中可能含有以下离子中的若干种:Na+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-,现分别取100mL的两份溶液进行如下实验.
①第一份加过量NaOH溶液后加热,收集到0.01mol气体,无沉淀生成,同时得到溶液甲.
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体.
③第二份加足量BaCl2溶液后,生成白色沉淀,过滤后的沉淀经足量盐酸洗涤、干燥后,得到11.65g固体,向滤液中加入AgNO3溶液又有白色沉淀产生.下列有关叙述正确的是( )
①第一份加过量NaOH溶液后加热,收集到0.01mol气体,无沉淀生成,同时得到溶液甲.
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体.
③第二份加足量BaCl2溶液后,生成白色沉淀,过滤后的沉淀经足量盐酸洗涤、干燥后,得到11.65g固体,向滤液中加入AgNO3溶液又有白色沉淀产生.下列有关叙述正确的是( )
| A. | 由①可知原溶液存在离子为NH4+,其浓度为0.01mol/L | |
| B. | 原溶液一定存在Cl- | |
| C. | 原溶液肯定没有Fe3+、Mg2+,一定含有Na+ | |
| D. | n(NH4+):n(Al3+):n(SO42-)=1:1:5 |
 (6)氯仿 (7)三氯甲烷(8)臭氧(9)氧气
(6)氯仿 (7)三氯甲烷(8)臭氧(9)氧气