题目内容
19.下列有关物质分类或归类正确的一组是( )①酸性氧化物:SO2、NO、CO2、SiO2
②蛋白质、盐酸、水玻璃、氨水均为混合物
③明矾、小苏打、硫酸钡、HClO均为电解质
④碘酒、牛奶、豆浆、漂粉精均为胶体
⑤液氨、液氯、干冰、碘化银均为化合物.
| A. | ①和③ | B. | ③和④ | C. | ②和③ | D. | ②和⑤ |
分析 ①酸性氧化物是可以和碱之间反应生成盐和水的氧化物;
②依据混合物是不同物质组成的分析;
③电解质是水溶液中或熔融状态下导电的化合物;
④胶体的本质特征是分散质微粒直径在1nm-100nm间;
⑤化合物是不同元素组成的纯净物,液氨是氨气属于化合物、液氯是单质.
解答 解:①SO2、CO2、SiO2是酸性氧化物,NO不是,故错误;
②盐酸是氯化氢水溶液、氨水是氨气的水溶液、水玻璃是硅酸钠的水溶液,都是混合物,此外蛋白质也是混合物,故②正确;
③明矾(属于盐类)、小苏打(属于盐类)、HClO、硫酸钡在水溶液或是熔融状态下能导电,属于电解质,均为电解质,故③正确;
④碘酒和漂粉精属于溶液分散系、牛奶、豆浆是胶体,故④错误;
⑤液氯是单质,液氨、干冰、碘化银均为化合物,故①错误;
综上所述:②③正确;
故选C.
点评 本题考查了化学基本概念的理解和应用,熟悉混合物、化合物、单质、电解质、非电解质等概念的分析即可判断,掌握物质的组成是解题关键,题目难度不大.

练习册系列答案
相关题目
16.已知:Fe+Cu2+═Cu+Fe2+和2Fe3++Cu═2Fe2++Cu2+,则下列判断不正确的是( )
| A. | Fe3+、Cu2+、Fe2+氧化性依次减弱 | |
| B. | 可发生反应:Fe+2Fe3+═2Fe2+ | |
| C. | Fe、Fe2+、Cu还原性依次减弱 | |
| D. | 将铁、铜混合粉末放入FeCl3溶液中,铁粉先溶解 |
10.下列说法正确的是( )
| A. | 体积相同,浓度都为 0.1 mol•L-1的盐酸和醋酸分别与体积相同 2 mol•L-1的NaOH溶液反应,两者速率相同 | |
| B. | 用锌和稀硫酸反应制取氢气时,加入少量硫酸铜固体会使生成氢气的速率加快 | |
| C. | Mg粉和Al粉分别与0.1 mol•L-1的NaOH溶液反应,Mg粉反应速率快 | |
| D. | 相同温度下,大理石块与大理石粉分别与盐酸反应,大理石块的反应速率慢 |
14.能正确表示下列化学反应的离子方程式正确的是( )
| A. | 碳酸钙溶于稀盐酸中Ca CO3+2 H+═H2O+CO2↑+Ca2+ | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2 H+═Ca2++2 H2O | |
| C. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO2↑+H2O | |
| D. | 氢氧化镁与盐酸的反应OH-+H+═H2O |
4.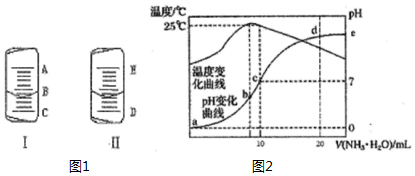 (1)如图1中的图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为5,量筒中液体的体积是3.6mL.
(1)如图1中的图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为5,量筒中液体的体积是3.6mL.
(2)如图1中的图II表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)D.
A.是amLB.是(50-a)mL C.-定大于amLD.一定大于(50-a)mL
(3)某校化学兴趣小组的同学用0.1000mol•L-1的NaOH标准溶液对一含有少量杂质(杂质不参与反应)的冰醋酸进行测定,回答下列问题:
①用分析天平准确称取该样品2.500g,全部溶于水配制成250mL的溶液,量取其中20.00mL放在锥形瓶中,滴加几滴指示剂,等待测定,该中和滴定中可选用的指示剂是酚酞,滴定终点的现象是当最后一滴NaOH溶液滴入时,待测液由无色变为粉红色,且半分钟内颜色不恢复.
②用0.10mol•L-1的NaOH标准溶液滴定进行滴定,实验数据如表所示,
计算样品中冰醋酸的质量百分含量为72%.
③若读酸式滴定管读数时,滴定前仰视读数,滴定正确读数,则所测结果偏大;
(4)在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如下图所示,回答下列问题:
①a,b,c,d四点所对应的溶液中,水的电离程度由小到大的顺序为a<d<c<b(用“<”连接)
②c点的 c(NH4+ )=0.5mol•L-1
③请结合图2中信息及题目中数据,用含有n的式子列出Kb(NH3•H2O)的表达式(n-1)×10-7.
 (1)如图1中的图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为5,量筒中液体的体积是3.6mL.
(1)如图1中的图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为5,量筒中液体的体积是3.6mL.(2)如图1中的图II表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)D.
A.是amLB.是(50-a)mL C.-定大于amLD.一定大于(50-a)mL
(3)某校化学兴趣小组的同学用0.1000mol•L-1的NaOH标准溶液对一含有少量杂质(杂质不参与反应)的冰醋酸进行测定,回答下列问题:
①用分析天平准确称取该样品2.500g,全部溶于水配制成250mL的溶液,量取其中20.00mL放在锥形瓶中,滴加几滴指示剂,等待测定,该中和滴定中可选用的指示剂是酚酞,滴定终点的现象是当最后一滴NaOH溶液滴入时,待测液由无色变为粉红色,且半分钟内颜色不恢复.
②用0.10mol•L-1的NaOH标准溶液滴定进行滴定,实验数据如表所示,
| 实验编号 | 待测CH3COOH溶液的体积/mL | NaOH溶液的体积/mL |
| 1 | 20.00 | 24.01 |
| 2 | 20.00 | 23.99 |
| 3 | 20.00 | 22.10 |
③若读酸式滴定管读数时,滴定前仰视读数,滴定正确读数,则所测结果偏大;
(4)在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如下图所示,回答下列问题:
①a,b,c,d四点所对应的溶液中,水的电离程度由小到大的顺序为a<d<c<b(用“<”连接)
②c点的 c(NH4+ )=0.5mol•L-1
③请结合图2中信息及题目中数据,用含有n的式子列出Kb(NH3•H2O)的表达式(n-1)×10-7.
11.下列物质不能由单质间直接化合得到的是( )
| A. | FeS | B. | Na2O2 | C. | CuS | D. | Mg3N2 |
8.下列事实中,不能用勒夏特列原理解释的是( )
| A. | 对于2HI(g)?H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 | |
| B. | 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 | |
| C. | 工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| D. | 冰镇的啤酒打开后泛起泡沫 |
9.胶体区别于其他分散系的本质特征是( )
| A. | 产生丁达尔现象 | B. | 分散质粒子直径 在1-100nm之间 | ||
| C. | 胶体微粒不能透过半透膜 | D. | 加热会聚沉 |