题目内容
18.反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的为( )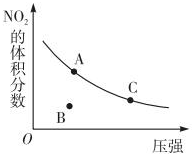
| A. | A、C两点的反应速率:v(A)>v(C) | |
| B. | A、C两点气体的颜色:A深,C浅 | |
| C. | B点正逆反应速率:v(正)>v(逆) | |
| D. | A、C两点气体的平均相对分子质量:A>C |
分析 A、压强越大反应速率越快;
B、增大压强向气体体积缩小;
C、B不是平衡状态,在这种压强下最终要达平衡状态,二氧化氮的体积分数变大;
D、A到C二氧化氮的体积分数减小,所以混合气体的物质的量减小.
解答 解:A、压强越大反应速率越快,C点的压强大,所以速率快,所以v(A)<v(C),故A错误;
B、增大压强向气体体积缩小,二氧化氮的浓度变大,所以颜色A浅,C深,故B错误;
C、B不是平衡状态,在这种压强下最终要达平衡状态,二氧化氮的体积分数变大,平衡正向移动,所以v(正)>v(逆),故C正确;
D、A到C二氧化氮的体积分数减小,所以混合气体的物质的量减小,气体质量不变,所以平均相对分子质量:A<C,故D错误;
故选C.
点评 本题考查化学平衡移动图象问题,题目难度中等,本题注意把握曲线的含义,以此判断反应进行方向.

练习册系列答案
相关题目
9.下列各组离子中,能在水溶液中大量共存的是( )
| A. | Na+、H+、Cl-、HCO3- | B. | Na+、Fe2+、Cl-、OH- | ||
| C. | NH4+、CO32-、NO3-、Ba2+ | D. | Cu2+、Fe3+、Mg2+、SO42- |
6.某无色透明溶液与金属铁反应时只放出氢气,则溶液中可以大量共存的离子是( )
| A. | Na+、S2-、H+、SO42- | B. | H+、NO3-、Ba2+、Mg2+ | ||
| C. | Na+、Cl-、H+、SO42- | D. | Ba2+、K+、CO32-、OH- |
13.下列颜色变化与氧化还原反应无关的是( )
| A. | 乙醇使酸性K2Cr2O7溶液由橙色变为绿色 | |
| B. | 向品红溶液中通入SO2气体,品红褪色,加热后又恢复红色 | |
| C. | 将铜丝在空气中烧黑后.趁热插入乙醇中又变红 | |
| D. | 将乙醛加人到新制Cu(OH)2悬浊液中并加热至沸腾,出现红色沉淀 |
3.加入铝能放出H2的溶液中一定可以大量共存的离子组是( )
| A. | Al3+、Na+、AlO2-、Cl- | B. | Mg2+、Cu2+、SO42-、HCO3- | ||
| C. | Fe3+、Na+、SCN-、CO32- | D. | K+、Na+、Cl-、SO42- |
10.120mL含有0.20mol碳酸钠溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
| A. | 1.2 mol/L | B. | 2.0mol/L | C. | 0.18 mol/L | D. | 0.24mol/L |
7.正确书写离子方程式时,下列各项中,应使等式两边相等的是( )
①离子数目相等②粒子总数相等③原子数目相等④阳离子所带正电荷总数跟阴离子所带负电荷总数相等⑤分子数目相等⑥各元素原子数目相等.
①离子数目相等②粒子总数相等③原子数目相等④阳离子所带正电荷总数跟阴离子所带负电荷总数相等⑤分子数目相等⑥各元素原子数目相等.
| A. | 只有①⑤ | B. | 只有②④ | C. | 只有③⑥ | D. | 只有④⑥ |
11.下列根据热化学方程式得出的结论正确的是( )
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则稀H2SO4和稀Ba(OH)2溶液反应生成2 mol H2O的反应热△H=-2×57.3 kJ/mol | |
| B. | 已知S(s)+$\frac{3}{2}$O2(g)═SO3(g)△H=-395.7 kJ/mol,则硫磺的燃烧热为395.7 kJ/mol | |
| C. | 已知C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,则金刚石比石墨稳定 | |
| D. | 已知2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol,则H2的燃烧热为285.8 kJ/mol |