题目内容
13.下列颜色变化与氧化还原反应无关的是( )| A. | 乙醇使酸性K2Cr2O7溶液由橙色变为绿色 | |
| B. | 向品红溶液中通入SO2气体,品红褪色,加热后又恢复红色 | |
| C. | 将铜丝在空气中烧黑后.趁热插入乙醇中又变红 | |
| D. | 将乙醛加人到新制Cu(OH)2悬浊液中并加热至沸腾,出现红色沉淀 |
分析 与氧化还原反应无关,说明该反应中没有电子转移,其特征是没有元素化合价升降,以此来解答.
解答 解:A.2K2Cr2O7+3C2H5OH+8H2SO4=2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O,Cr2O72-转化为Cr3+,C元素化合价由-2价变为0价,有电子转移,所以属于氧化还原反应,故A不选;
B.向品红溶液中通入SO2气体,品红褪色,发生化合反应生成无色物质,加热后无色物质分解,该反应中各元素化合价不变,没有电子转移,所以不属于氧化还原反应,故B选;
C.烧黑生成CuO,Cu、O元素的化合价变化,趁热插入乙醇中又变红,乙醇被氧化铜氧化,所以有电子转移,属于氧化还原反应,故C不选;
D.CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O,该反应中C元素化合价由-1价变为0价、Cu元素化合价由+2价变为+1价,所以有电子转移,属于氧化还原反应,故D不选;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意现象与反应的关系,题目难度不大.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
3.已知:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O; Cl2+2FeCl2═2FeCl3; 2KI+2FeCl3═2KCl+I2+2FeCl2. 则下列判断正确的是( )
| A. | 氧化性MnO4->Cl2>I2>Fe3+ | B. | 还原性:Fe2+>I->Cl- | ||
| C. | Fe3+能将I-氧化为I2 | D. | Fe2+只有还原性 |
4.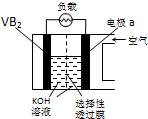 硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如图所示,该电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.下列说法正确的是( )
硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如图所示,该电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.下列说法正确的是( )
 硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如图所示,该电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.下列说法正确的是( )
硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如图所示,该电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.下列说法正确的是( )| A. | 电极a为电池正极 | |
| B. | 图中选择性透过膜只能让阳离子选择性透过 | |
| C. | 电子由VB2极经KOH溶液流向a电极 | |
| D. | VB2极发生的电极反应为:2VB2+22OH--22e-═V2O5+2B2O3+11H2O |
8.下列各醇中,能发生消去反应生成(CH3)2C═CH2的是( )
| A. | CH3-OH | B. |  | C. | C2H5OH | D. |  |
18.反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的为( )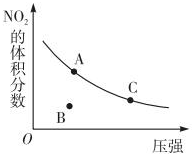

| A. | A、C两点的反应速率:v(A)>v(C) | |
| B. | A、C两点气体的颜色:A深,C浅 | |
| C. | B点正逆反应速率:v(正)>v(逆) | |
| D. | A、C两点气体的平均相对分子质量:A>C |
5.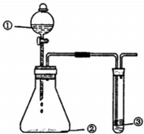 用如图所示装置进行下列实验,有关分析一定不正确的是
用如图所示装置进行下列实验,有关分析一定不正确的是
( )
 用如图所示装置进行下列实验,有关分析一定不正确的是
用如图所示装置进行下列实验,有关分析一定不正确的是( )
| 选項 | ① | ② | ③ | 预期现象或结论 |
| A | 稀H2SO4 | Na2SO3 | 澄清石灰水 | 滴入少量稀H2SO4时③中立即出现浑浊 |
| B | H2O2溶液 | FeCl3 | FeCl2溶液 | FeCl3作催化剂 |
| C | 盐酸 | KMnO4 | 淀粉KI溶液 | 氧化性:KMnO4>Cl2>I2 |
| D | 浓 HNO3 | Cu粉 | 石蕊溶液 | ③中可能先变后褪色 |
| A. | A | B. | B | C. | C | D. | D |
2.向Fe2O3和Fe组成的混合物中加入适量的稀H2SO4,各物质均恰好完全反应,测得所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为5:2,那么反应中消耗Fe2O3、Fe、H2SO4物质的量之比为( )
| A. | 1:1:1 | B. | 1:2:4 | C. | 1:2:3 | D. | 1:3:5 |
6.铁及其化合物在日常生活中应用广泛.已知Fe(NO3)3•9H2O易溶于水,微溶于硝酸,主要用作催化剂和媒染剂.工业上用细铁屑(含有少量杂质Cu)与稀硝酸反应制备,主要流程如下:
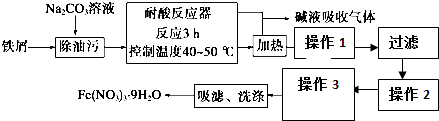
(1)Na2CO3溶液可以除油污,原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-
(2)操作1加入烧碱溶液,调节pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L,能否视为Fe3+已经沉淀完全?是(是、否).
(3)操作2是在滤渣中加入足量的硝酸,硝酸足量的目的将Fe(OH)3完全溶解、抑制Fe3+水解
(4)操作3包含两步,分别为:蒸发浓缩、冷却结晶
(5)制得的Fe(NO3)3•9H2O用20% HNO3洗涤,目的:洗去表面杂质,减少因溶解而造成的损失.

| 物质 | Cu(OH)2 | Fe(OH)3 |
| Ksp | 2.2×10-20 | 2.6×10-39 |
(2)操作1加入烧碱溶液,调节pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L,能否视为Fe3+已经沉淀完全?是(是、否).
(3)操作2是在滤渣中加入足量的硝酸,硝酸足量的目的将Fe(OH)3完全溶解、抑制Fe3+水解
(4)操作3包含两步,分别为:蒸发浓缩、冷却结晶
(5)制得的Fe(NO3)3•9H2O用20% HNO3洗涤,目的:洗去表面杂质,减少因溶解而造成的损失.