题目内容
6.某无色透明溶液与金属铁反应时只放出氢气,则溶液中可以大量共存的离子是( )| A. | Na+、S2-、H+、SO42- | B. | H+、NO3-、Ba2+、Mg2+ | ||
| C. | Na+、Cl-、H+、SO42- | D. | Ba2+、K+、CO32-、OH- |
分析 与金属铁反应时只放出氢气,溶液显酸性,根据离子之间不能结合生成沉淀、气体、水、弱电解质等,不能发生氧化还原反应等,则离子大量共存,并结合离子的颜色来解答.
解答 解:与金属铁反应时只放出氢气,溶液显酸性,
A.S2-、H+结合生成弱电解质,不能共存,故A错误;
B.Fe、H+、NO3-发生氧化还原反应不生成氢气,故B错误;
C.酸性溶液中该组离子之间不反应,且离子均为无色,故C正确;
D.酸性溶液中不能大量存在CO32-、OH-,且Ba2+、CO32-结合生成沉淀不能共存,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重氧化还原反应、复分解反应的离子共存考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.将物质的量均为0.1molK2SO4和Al2(SO4)3溶于水,向其中加入一定量的Ba(OH)2溶液,测得铝元素有一半留在溶液中,则生成BaSO4的物质的量可能为( )
| A. | 0.25mol | B. | 0.30mol | C. | 0.35mol | D. | 0.4mol |
14.常温下,下列溶液中各离子浓度关系正确的是( )
| A. | 醋酸溶液与NaOH溶液相混合后,所得溶液呈中性:c(Na+)>c(CH3COO-) | |
| B. | 浓度为0.1 mol•L-1的碳酸钠溶液:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | pH=12的氨水溶液与pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 等物质的量的氨水和盐酸混合后的溶液:c(H+)=c(OH-)+c(NH3•H2O) |
11.下列关于浓硝酸和浓硫酸的叙述,正确的是( )
| A. | 常温下都能用铝制容器贮存 | |
| B. | 露置在空气中,容器内酸液的质量都减轻 | |
| C. | 常温下都能与铜较快地反应 | |
| D. | 露置在空气中,容器内溶质的浓度都升高 |
18.反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的为( )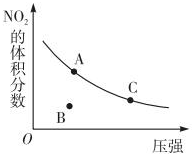

| A. | A、C两点的反应速率:v(A)>v(C) | |
| B. | A、C两点气体的颜色:A深,C浅 | |
| C. | B点正逆反应速率:v(正)>v(逆) | |
| D. | A、C两点气体的平均相对分子质量:A>C |
15.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | $\frac{{K}_{W}}{c{(H}^{+})}$=10-13 mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| B. | 含有0.1 mol•L-1 Fe3+的溶液:Na+、K+、SCN-、NO3- | |
| C. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
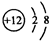 ,S2-的结构示意图
,S2-的结构示意图 .
.