题目内容
10.120mL含有0.20mol碳酸钠溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )| A. | 1.2 mol/L | B. | 2.0mol/L | C. | 0.18 mol/L | D. | 0.24mol/L |
分析 根据碳酸钠滴入盐酸中的反应及盐酸滴入碳酸钠中的反应,结合都有气体产生,但最终生成的气体体积不同来找出盐酸与碳酸钠的物质的量的关系,根据盐酸的浓度范围值来确定答案.
解答 解:当碳酸钠滴入盐酸中时发生CO32-+2H+═H2O+CO2↑,
当盐酸滴入碳酸钠溶液时,反应顺序为CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,则HCl的物质的量应大于Na2CO3的物质的量,又因为最终生成的气体体积不同,
则HCO3-+H+=H2O+CO2不能全部完成,即HCl的物质的量比Na2CO3的物质的量的二倍少,
碳酸钠的物质的量为0.2mol,
则HCl的物质的量应介于0.2mol~0.4mol之间,
盐酸溶液的体积为200mL=0.2L,
即盐酸的浓度应该是大于1mol/L,小于2mol/L.
故选A.
点评 本题考查学生利用盐酸与碳酸钠的反应分析盐酸的浓度,明确反应发生的先后顺序,通过比较及信息中都有气体产生,但最终生成的气体体积不同是解答的关键.

练习册系列答案
相关题目
20.下列化学用语正确的是( )
| A. | 硫酸铁的化学式为FeSO4 | |
| B. | 氧离子结构示意图: | |
| C. | 碳酸氢钠的电离方程式 NaHCO3═Na++HCO3- | |
| D. | 质量数为37的氯核素符号:${\;}_{37}^{17}$Cl |
18.反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的为( )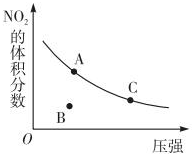

| A. | A、C两点的反应速率:v(A)>v(C) | |
| B. | A、C两点气体的颜色:A深,C浅 | |
| C. | B点正逆反应速率:v(正)>v(逆) | |
| D. | A、C两点气体的平均相对分子质量:A>C |
5. 用如图所示装置进行下列实验,有关分析一定不正确的是
用如图所示装置进行下列实验,有关分析一定不正确的是
( )
 用如图所示装置进行下列实验,有关分析一定不正确的是
用如图所示装置进行下列实验,有关分析一定不正确的是( )
| 选項 | ① | ② | ③ | 预期现象或结论 |
| A | 稀H2SO4 | Na2SO3 | 澄清石灰水 | 滴入少量稀H2SO4时③中立即出现浑浊 |
| B | H2O2溶液 | FeCl3 | FeCl2溶液 | FeCl3作催化剂 |
| C | 盐酸 | KMnO4 | 淀粉KI溶液 | 氧化性:KMnO4>Cl2>I2 |
| D | 浓 HNO3 | Cu粉 | 石蕊溶液 | ③中可能先变后褪色 |
| A. | A | B. | B | C. | C | D. | D |
15.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | $\frac{{K}_{W}}{c{(H}^{+})}$=10-13 mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| B. | 含有0.1 mol•L-1 Fe3+的溶液:Na+、K+、SCN-、NO3- | |
| C. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
2.向Fe2O3和Fe组成的混合物中加入适量的稀H2SO4,各物质均恰好完全反应,测得所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为5:2,那么反应中消耗Fe2O3、Fe、H2SO4物质的量之比为( )
| A. | 1:1:1 | B. | 1:2:4 | C. | 1:2:3 | D. | 1:3:5 |
 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g) 在反应中被氧化为1mol SO3(g) 的△H=-99kJ/mol.回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g) 在反应中被氧化为1mol SO3(g) 的△H=-99kJ/mol.回答下列问题: