题目内容
13.下列关于环境问题的说法正确的是( )| A. | 燃煤时加适量的生石灰可减少二氧化硫的排放 | |
| B. | pH在5.6~7.0之间的降水通常称为酸雨 | |
| C. | 焚烧一次性饭盒可减少白色污染 | |
| D. | 实验室可用氢氧化钠溶液除去尾气中的NO气体 |
分析 A.燃煤时生成二氧化硫,二氧化硫导致酸雨的发生,加CaO与二氧化硫反应;
B.酸雨的pH<5.6;
C.焚烧一次性饭盒可生成致癌性物质;
D.NO与NaOH溶液不反应.
解答 解:A.燃煤时生成二氧化硫,二氧化硫导致酸雨的发生,加CaO与二氧化硫反应,可减少二氧化硫的排放,故A正确;
B.酸雨的pH<5.6,正常雨水的pH约为5.6,故B错误;
C.焚烧一次性饭盒可生成致癌性物质,不能焚烧,应使用聚乳酸代替塑料的使用,减少白色污染,故C错误;
D.NO与NaOH溶液不反应,应用氧气、NaOH处理尾气,故D错误;
故选A.
点评 本题考查三废处理及环境保护,为高频考点,把握物质的性质、环境保护、尾气处理为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.

练习册系列答案
相关题目
3.工业上利用反应2FeSO4+NaBH4+4NaOH=2Fe+2H2↑+Na[B(OH)4]+2Na2SO4制取纳米铁,下列说法不正确的是( )
| A. | NaBH4与盐酸不反应 | |
| B. | NaBH4的电子式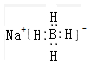 | |
| C. | 每生成1molFe,转移2mol电子 | |
| D. | 氧化产物与还原产物的物质的量之比为1:1 |
8.Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色反应呈黄色,五种元素核电荷数之和为54,W、Z最外层电子数相同,Z的核电荷数是W的2倍,工业上一般通过电解氧化物的方法获得Y的单质,则下列说法不正确的是( )
| A. | 原子半径:X>Y>Z>Q>W | |
| B. | X、Y和Z三种元素的最高价氧化物的水化物两两间能反应 | |
| C. | 阳离子的氧化性:X>Y | |
| D. | W的最简单氢化物沸点比Z的高 |
18.下列叙述正确的是( )
| A. | 通常,同周期元素的第一电离能ⅦA族的元素最大 | |
| B. | 在同一主族中,自上而下第一电离能逐渐减小 | |
| C. | 第ⅠA、ⅡA族元素的原子,其半径越大,第一电离能越大 | |
| D. | 主族元素的原子形成单原子离子时的化合价数都和它的族序数相等 |
5.下列表述中正确的是( )
| A. | 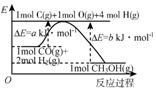 根据图可知合成甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH (g)△H=(b-a)kJ•mol-1 | |
| B. |  图表示2molH2(g)所具有的能量比2mol气态水所具有的能量多483.6kJ | |
| C. | 1molNaOH分别和1molCH3COOH、1molHNO3反应,后者比前者△H小 | |
| D. | 汽油燃烧时将全部的化学能转化为热能 |
2.设NA表示阿伏伽德罗常数值.下列说法正确的是( )
| A. | 标准状况下,11.2L的甲醇所含的氢原子数等于2NA | |
| B. | 常温常压下,Na2O2 与 H2O 反应生成 1mol O2 时,转移电子数是 2NA | |
| C. | 25℃时,Kap(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-6 NA | |
| D. | 1L 1 mol/L AlCl3溶液中含有的Al3+数目为NA |
3. 常温下,A是由X 和Y 两种短周期元素组成的气体,X的原子序数小于Y,甲、乙、丙分别是X、Y、Z元素对应的单质,Z是地壳中含量最高的元素,它们有如图所示的转化关系.下列说法不正确的是( )
常温下,A是由X 和Y 两种短周期元素组成的气体,X的原子序数小于Y,甲、乙、丙分别是X、Y、Z元素对应的单质,Z是地壳中含量最高的元素,它们有如图所示的转化关系.下列说法不正确的是( )
 常温下,A是由X 和Y 两种短周期元素组成的气体,X的原子序数小于Y,甲、乙、丙分别是X、Y、Z元素对应的单质,Z是地壳中含量最高的元素,它们有如图所示的转化关系.下列说法不正确的是( )
常温下,A是由X 和Y 两种短周期元素组成的气体,X的原子序数小于Y,甲、乙、丙分别是X、Y、Z元素对应的单质,Z是地壳中含量最高的元素,它们有如图所示的转化关系.下列说法不正确的是( )| A. | X、Y、Z三种元素可能组成是离子化合物 | |
| B. | 反应②为化合反应,反应③为置换反应 | |
| C. | 常温常压下,Z的氢化物熔点为同族最高 | |
| D. | 原子半径:Y>Z>X |
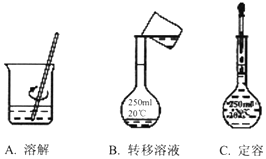 实验室需要配制250mL 1.6mol•L-1的NaOH溶液,请回答下列问题:
实验室需要配制250mL 1.6mol•L-1的NaOH溶液,请回答下列问题: 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.