题目内容
16.根据要求完成题目.(1)与氩原子电子层结构相同的-2价阴离子的结构示意图
 .
.(2)写出含有6个质子,8个中子的原子的化学符号是614C.
(3)用“<”或“>”填空:A.酸性:H2SO4<HClO4,B.碱性:Ca(OH)2<Ba(OH)2
(4)用电子式表示氯化镁的形成过程
 .
.
分析 (1)与氩原子电子层结构相同的-2价阴离子为S2-;
(2)含有6个质子,8个中子的原子为614C;
(3)元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,金属性越强,对应的最高价氧化物的水化物的碱性越强;
(4)氯化镁为离子化合物,由离子形成离子键.
解答 解:(1)与氩原子电子层结构相同的-2价阴离子应含有16个质子,原子核外有18个电子,为S2-,结构示意图为 ,故答案为:
,故答案为: ;
;
(2)含有6个质子,8个中子的原子为614C,故答案为:614C;
(3)非金属性Cl>S,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性H2SO4<HClO4,金属性Ba>Ca,金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性Ca(OH)2<Ba(OH)2,故答案为:<,<;
(4)氯化镁为离子化合物,由离子形成离子键,其形成过程为 ,
,
故答案为: .
.
点评 本题考查结构示意图、电子式的书写以及元素周期率等知识,为高频考点,题目难度不大,注意共价化合物和离子化合物的电子式书写方法的不同,简单阳离子电子式为其离子符号,阴离子、复杂阳离子应标出最外层电子或成键情况,用[]括起并在右上角注明所带电荷.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
13.下列说法正确的是( )
| A. | NaCl晶体中每个钠离子与周围6个氯离子形成6个离子键 | |
| B. | 前四周期元素的原子中,未成对电子数最多的是Mn | |
| C. | 金属导电的原因是在外电场作用下金属产生自由电子,电子定向运动 | |
| D. | 岩浆冷却过程中,晶格能高的矿物晶体先结晶 |
7.在一定条件下,可逆反应2A?B+3C在下列4种状态中,处于平衡状态的是( )
| A. | 正反应速度 vA=2mol/(L•min)逆反应速度vB=2 mol/(L•min) | |
| B. | 正反应速度 vA=2mol/(L•min)逆反应速度vC=2 mol/(L•min) | |
| C. | 正反应速度 vA=1mol/(L•min)逆反应速度vB=1.5 mol/(L•min) | |
| D. | 正反应速度 vA=1mol/(L•min)逆反应速度vC=1.5mol/(L•min) |
11.下列物质中既含有离子键,又含有共价键的是( )
| A. | KCl | B. | PCl3 | C. | NH3•H2O | D. | Na2O2 |
1.下列有关化学用语使用正确的是( )
| A. | 符号为${\;}_8^{18}O$的原子常用于文物年代的测定 | |
| B. | CO2分子比例模型: | |
| C. | H2O2的电子式: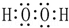 | |
| D. | 结构简式为CH2CH2的分子可发生加成反应 |
8.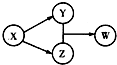 X、Y、Z、W四种物质的转化关系如图所示(部分反应物与产物已略),下列组合中不符合该关系的是( )
X、Y、Z、W四种物质的转化关系如图所示(部分反应物与产物已略),下列组合中不符合该关系的是( )
 X、Y、Z、W四种物质的转化关系如图所示(部分反应物与产物已略),下列组合中不符合该关系的是( )
X、Y、Z、W四种物质的转化关系如图所示(部分反应物与产物已略),下列组合中不符合该关系的是( )| A | B | C | D | |
| X | HCl | Na2O2 | Na2CO3 | Al |
| Y | FeCl2 | NaOH | CO2 | Na[Al(OH)4] |
| Z | Cl2 | Na2CO3 | CaCO3 | AlCl3 |
| W | FeCl3 | NaHCO3 | Ca(HCO3)2 | Al(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
6.下列描述正确的是( )
| A. | 伴随有能量变化的物质变化都是化学变化 | |
| B. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 | |
| C. | 已知相同条件下2SO2(g)+O2(g)?2SO3(g)△H1,反应2SO2(s)+O2(g)?2SO3(g)△H2,则△H1>△H2 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓H2SO4与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ |

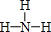 .②的简单气态氢化物的电子式为
.②的简单气态氢化物的电子式为 .
.