题目内容
19.一定质量的金属铜,加入50mL10mol/L的浓硝酸充分反应后,铜完全溶解,共放出标准状况下的气体4.48L.(1)若气体只有NO2,计算铜的质量.
(2)若气体为NO2和NO,且硝酸也恰好完全反应,计算铜的质量.
分析 (1)若气体只有NO2,发生反应:Cu+4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2+2NO2↑+2H2O,计算二氧化氮的物质的量,再根据方程式计算参加反应Cu的物质的量,根据m=nM计算参加反应Cu的质量;
(2)根据N元素守恒计算n[Cu(NO3)2],由Cu元素守恒可知n(Cu)=n[Cu(NO3)2].
解答 解:(1)若气体只有NO2,其物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,
Cu+4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2+2NO2↑+2H2O
1 2
n(Cu) 0.2mol
所以n(Cu)=$\frac{0.2mol×1}{2}$=0.1mol
故Cu的质量为0.1mol×64g/mol=6.4g
答:Cu的质量为6.4g.
(2)若气体为NO2和NO,它们物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,
根据N元素守恒:n(HNO3)=2n[Cu(NO3)2]+n(NO2)+n(NO),则n[Cu(NO3)2]=$\frac{0.05L×10mol/L-0.2mol}{2}$=0.15mol,
由Cu元素守恒可知n(Cu)=n[Cu(NO3)2]=0.15mol,
故Cu的质量为0.15mol×64g/mol=9.6g
答:Cu的质量为9.6g.
点评 本题考查化学方程式有关计算,明确发生的反应即可解答,侧重考查学生分析计算能力,(2)中注意利用守恒法解答.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
10.有关下列装置的叙述不正确的是( )
| A. | 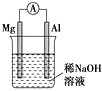 图铝片发生的电极反应式是:Al+4OH-3e-═AlO2-+2H2O | |
| B. |  图发生析氢腐蚀,离子反应方程式为:Fe+2H+═Fe2++H2↑ | |
| C. | 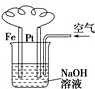 图溶液中发生了变化:4Fe(OH)2+O2+2H2O═4Fe(OH)3 | |
| D. | 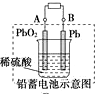 图充电时,阳极反应是:PbSO4+2H2O-2e-═=PbO2+SO42-+4H+ |
7.下列关于溶液和胶体的叙述正确的是( )
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 胶体粒子可以通过半透膜而溶液不行,故可以用半透膜来分离胶体和溶液 | |
| C. | 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 | |
| D. | 溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 |
14.下列叙述错误的是( )
| A. | 节假日燃放的五彩缤纷的烟花,和一些金属元素的焰色反应有关 | |
| B. | 硅胶常作实验室和袋装食品等的干燥剂 | |
| C. | 正常雨水的pH是5.6,酸雨的pH大于5.6 | |
| D. | 二氧化硅是现代光纤的原料 |
4.下列物质的溶液中分别滴加Ba(OH)2溶液至过量,反应产生的沉淀的质量(m)或物质的量(n)随加入的Ba(OH)2溶液体积关系图象正确的是( )
| A. | 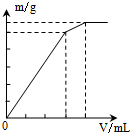 Al2(SO4)2 | B. | 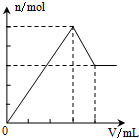 KAl(SO4)2 | C. | 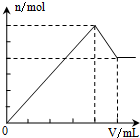 NH4Al(SO4)2 | D. | 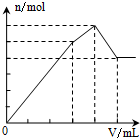 NH4Al(SO4)2 |
11.为建设“蓝天常在、青山常在、绿水常在”的美丽中国,2015年4月16日国务院颁布了《水污染防治行动计划》.下列做法有利于该目标实现的是( )
| A. | 推广使用含磷洗涤剂 | B. | 用工业污水直接灌溉农田 | ||
| C. | 用O3替代Cl2作饮用水消毒剂 | D. | 含Hg2+的废水直接排放 |
13.强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、A13+、CO32-、SO32-、SO42-、C1-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如下:
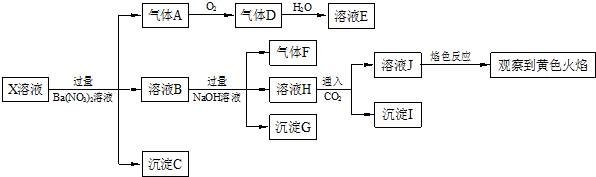
下列结论正确的是( )

下列结论正确的是( )
| A. | X中肯定存在Na+、Fe2+、A13+、NH4+、SO42- | |
| B. | 气体F经催化氧化可直接生成气体D | |
| C. | 沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I一定是Al(OH )3 | |
| D. | X中不能确定的离子是 A13+、Na+、K+和C1- |
 .
. 图所示水槽中的试管内有一枚铁钉(含少量的炭),放置数天后观察:
图所示水槽中的试管内有一枚铁钉(含少量的炭),放置数天后观察: