题目内容
10.有关下列装置的叙述不正确的是( )| A. | 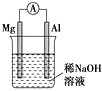 图铝片发生的电极反应式是:Al+4OH-3e-═AlO2-+2H2O | |
| B. |  图发生析氢腐蚀,离子反应方程式为:Fe+2H+═Fe2++H2↑ | |
| C. | 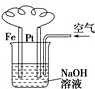 图溶液中发生了变化:4Fe(OH)2+O2+2H2O═4Fe(OH)3 | |
| D. | 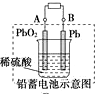 图充电时,阳极反应是:PbSO4+2H2O-2e-═=PbO2+SO42-+4H+ |
分析 A.强碱性条件下,Al失电子生成AlO2-;
B.醋酸是弱酸,在离子方程式中要写成分子;
C.铁发生吸氧腐蚀生成Fe(OH)2,Fe(OH)2被氧气氧化为Fe(OH)3;
D.铅蓄电池充电时,阳极上PbSO4失电子生成PbO2.
解答 解:A.Mg、Al、NaOH溶液构成的原电池中Al失电子作负极,强碱性条件下,Al失电子生成AlO2-,则铝片发生的电极反应式是:Al+4OH-3e-═AlO2-+2H2O,故A正确;
B.醋酸是弱酸,在离子方程式中要写成分子,则离子反应方程式为:Fe+2CH3COOH═Fe2++CH3COO-+H2↑,故B错误;
C.铁发生吸氧腐蚀生成Fe(OH)2,Fe(OH)2被氧气氧化为Fe(OH)3,则溶液中发生了变化:4Fe(OH)2+O2+2H2O═4Fe(OH)3,故C正确;
D.铅蓄电池充电时,阳极上PbSO4失电子生成PbO2,阳极反应是:PbSO4+2H2O-2e-═PbO2+SO42-+4H+,故D正确.
故选B.
点评 本题考查了原电池原理和电解池原理的应用,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力,注意把握电极的判断和电极方程式的书写.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
20.将充满20mL NO试管倒置于盛有蒸馏水的烧杯中,然后向试管中通入纯O2,当试管内液面稳定在试管容积的一半时,则通入O2为( )
| A. | 7.5 mL | B. | 17.5 mL | C. | 25.0 mL | D. | 35.0 mL |
1.将下列各组中的每种有机物分别放入水中,振荡后再静置,液体分层且该组的全部物质都能浮在水的上层的是( )
| A. | 1-己炔、甲苯、十一烷 | B. | 乙醇、苯、溴苯 | ||
| C. | 乙二醇、乙醛、硝基苯 | D. | 溴苯、四氯化碳、乙酸钠 |
18.下列说法不正确的是( )
| A. | 打开盛浓盐酸的试剂瓶可看到白色的酸雾,这说明HCl不稳定 | |
| B. | 蔗糖中滴入浓硫酸,蔗糖变黑,这说明浓硫酸具有脱水性 | |
| C. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 金属钠存放于煤油中 |
5.用惰性电极电解100mL 0.05mol/L的CuSO4的溶液,当电解到阴极刚好有气体析出时,溶液的PH值最接近于(不考虑溶液的体积变化)( )
| A. | 1.0 | B. | 1.3 | C. | 1.7 | D. | 2.0 |
15.用1.000mol/LNaOH溶液滴定0.100mol/LH2SeO3溶液,在下图曲线标注位置,下面什么物质含硒量最少占溶液中硒总量的10%.( )
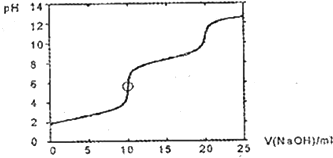

| A. | H2SeO3 | B. | H2SeO3和HSeO3- | C. | HSeO3- | D. | HSeO3-和SeO32- |
2.实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH${\;}_{4}^{+}$+6HCHO═3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1mol H+相当],然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ称取样品1.500g.
步骤Ⅱ将样品溶解后,完全转移到250mL容量瓶中,定容、充分摇匀.
步骤Ⅲ移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响(填“偏大”“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察B.
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变成粉红(或浅红)色.
(2)滴定结果如下表所示:
若NaOH标准溶液的浓度为0.101 0mol•L-1,则该样品中氮的质量分数为18.85%.(保留4位有效数字)
步骤Ⅰ称取样品1.500g.
步骤Ⅱ将样品溶解后,完全转移到250mL容量瓶中,定容、充分摇匀.
步骤Ⅲ移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响(填“偏大”“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察B.
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变成粉红(或浅红)色.
(2)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |