题目内容
1L稀硝酸和稀硫酸的混合溶液,其溶质的物质的量浓度分别为0.1mol/L 和0.4mol/L.若向该混合溶液中加入足量的铜粉.则最多能溶解铜粉的质量为( )
| A、2.4 g |
| B、3.2 g |
| C、6.4 g |
| D、9.6 g |
考点:化学方程式的有关计算
专题:计算题
分析:混合溶液中n(H+)=1L×0.1moL/L+2×1L×0.2mol/L=0.5mol,n(NO3-)=1L×0.1moL/L=0.1mol,加入铜粉发生:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,根据相关离子的物质的量结合离子方程式计算.
解答:
解:混合溶液中n(H+)=1L×0.1moL/L+2×1L×0.4mol/L=0.9mol,n(NO3-)=1L×0.1moL/L=0.1mol,
由离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知H+足量,NO3-完全反应,
则3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3mol 8mol 2mol
n 0.4mol 0.1mol
解得:n=0.15mol,
m(Cu)=0.15mol×64g/mol=9.6g.
故选D.
由离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知H+足量,NO3-完全反应,
则3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3mol 8mol 2mol
n 0.4mol 0.1mol
解得:n=0.15mol,
m(Cu)=0.15mol×64g/mol=9.6g.
故选D.
点评:本题考查离子方程式的计算,题目难度不大,本题注意根据硫酸和硝酸的物质的量结合离子方程式首先判断过量问题,为解答该题的关键,答题时注意体会做题思路.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
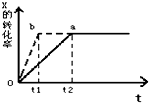 图中a曲线表示一定条件下的可逆反应:X(g)+Y(g)?2Z(g)+W(g);△H=QkJ/mol 的反应过程. 若使a曲线变为b曲线,可采取的措施是( )
图中a曲线表示一定条件下的可逆反应:X(g)+Y(g)?2Z(g)+W(g);△H=QkJ/mol 的反应过程. 若使a曲线变为b曲线,可采取的措施是( )| A、增大Y的浓度 |
| B、加入催化剂 |
| C、降低温度 |
| D、增大体系压强 |
下列电离或水解方程式正确的是( )
| A、Na2SO3的水解:SO3 2-+2H2O?H2SO3+2OH- |
| B、NaHCO3的电离:NaHCO3?Na++H++CO3 2- |
| C、KHS的电离:KHS=K++HS- |
| D、NaClO溶液与FeCl2溶液混合:2ClO-+Fe2++2H2O=2HClO+Fe(OH)2↓ |
下列有关物质结构的表述正确的是( )
A、甲醇比例模型 |
B、CO2的电子式: |
| C、乙醛结构简式:CH3COH |
D、Cl-的结构示意图  |
在地球上,氦元素主要以42He的形式存在,下列说法正确的是( )
| A、42He原子核内含有4个质子 |
| B、32He和42He互为同位素 |
| C、32He原子核内含有3个中子 |
| D、32He和42He是同一种核素 |
下列溶液中Cl-的物质的量与50mL 1mol?L-1 AlCl3溶液中Cl-物质的量相等的( )
| A、25 mL 2 mol?L-1的KCl溶液 |
| B、75 mL 2 mol?L-1KClO3溶液 |
| C、150 mL 1 mol?L-1的NaCl溶液 |
| D、75 mL 1 mol?L-1的FeCl3溶液 |