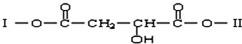题目内容
下列有关物质结构的表述正确的是( )
A、甲醇比例模型 |
B、CO2的电子式: |
| C、乙醛结构简式:CH3COH |
D、Cl-的结构示意图  |
考点:电子式、化学式或化学符号及名称的综合
专题:化学用语专题
分析:A.甲醇分子中,碳原子半径大于氧原子,所以其比例模型中碳原子的相对体积应该大于氧原子;
B.二氧化碳分子中存在两个碳氧双键,C、O原子的最外层都达到8电子稳定结构;
C.醛基的表示方法错误,应该表示为:-CHO;
D.氯离子的核电荷数为17,核外电子总数为18,最外层达到8电子稳定结构.
B.二氧化碳分子中存在两个碳氧双键,C、O原子的最外层都达到8电子稳定结构;
C.醛基的表示方法错误,应该表示为:-CHO;
D.氯离子的核电荷数为17,核外电子总数为18,最外层达到8电子稳定结构.
解答:
解:A.根据图示可知,黑色球为O原子,比例模型能够体现出原子的相对体积大小,碳原子半径大于氧原子半径,则甲醇的比例模型中黑色球相对体积应该小于蓝色的C原子,故A错误;
B.二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为: ,故B错误;
,故B错误;
C.乙醛分子中含有1个甲基和1个醛基,乙醛结构简式:CH3CHO,故C错误;
D.氯离子是由氯原子得到1个电子形成的,最外层达到8电子稳定结构,氯离子结构示意图为: ,故D正确;
,故D正确;
故选D.
B.二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为:
 ,故B错误;
,故B错误;C.乙醛分子中含有1个甲基和1个醛基,乙醛结构简式:CH3CHO,故C错误;
D.氯离子是由氯原子得到1个电子形成的,最外层达到8电子稳定结构,氯离子结构示意图为:
 ,故D正确;
,故D正确;故选D.
点评:本题考查了电子式、烃的衍生物官能团、离子结构示意图等,题目难度中等,注意掌握电子式、比例模型、结构简式等化学用语的表示方法,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
相关题目
“活化分子”是衡量化学反应速率快慢的重要依据,下列有关说法不正确的是( )
| A、能够发生有效碰撞的分子一定是活化分子 |
| B、增大浓度,单位体积内活化分子数增加,化学反应速率增大 |
| C、加入反应物,使活化分子百分数增大,化学反应速率增大 |
| D、一般使用催化剂可以降低反应的活化能,增大活化分子百分数,增大化学反应速率 |
下列事实可以得出最后结论的是( )
| A、常温下,反应:C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H<0 | ||
B、一定温度下,反应:MgO(l)═Mg(l)+
| ||
| C、CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | ||
| D、已知反应:C(s)+H2O(g)→CO(g)+H2(g)△H=+131.4kJ,该反应在常温下一定可自发进行 |
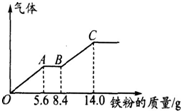 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )| A、H2SO4浓度为2.5 mol?L-1 |
| B、第二份溶液中最终溶质为FeSO4 |
| C、OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 |
| D、原混合酸中NO3-物质的量为0.1mol |
1L稀硝酸和稀硫酸的混合溶液,其溶质的物质的量浓度分别为0.1mol/L 和0.4mol/L.若向该混合溶液中加入足量的铜粉.则最多能溶解铜粉的质量为( )
| A、2.4 g |
| B、3.2 g |
| C、6.4 g |
| D、9.6 g |
分析发现,某陨石中含有半衰期极短的镁的一种放射性同位素28Mg,该同位素的原子核内的中子数是( )
| A、12 | B、14 | C、16 | D、18 |
下列有关化学用语使用正确的是( )
A、HClO的电子式:H:
| ||||||||
B、具有16个质子、16个中子和18个电子的微粒是
| ||||||||
C、邻羟基苯甲酸的结构简式: | ||||||||
D、乙烯的比例模型: |