题目内容
氮、磷、锌是与生命活动密不可分的元素.请回答下列问题:
(1)NH3和PH3都是极性分子,其中极性较大的是 ,理由是 .
(2)NH4NO3是一种重要的化学肥料,其中N原子的杂化方式是 .
(3)已知磷酸分子中,P、O原子均满足最外层8个电子的稳定结构,则:
①P与非羟基O之间的共价键的形成方式是 .
②中和20mL0.1mol?L-1次磷酸(H3PO2)溶液需要0.1mol?L-1 NaOH溶液的体积恰好为 20mL,则H3PO2的结构式是 .
(4)Zn2+基态时的电子排布式是 ,ZnO和ZnS的晶体结构相似,其中熔点较高的是 ,理由是 .
(1)NH3和PH3都是极性分子,其中极性较大的是
(2)NH4NO3是一种重要的化学肥料,其中N原子的杂化方式是
(3)已知磷酸分子中,P、O原子均满足最外层8个电子的稳定结构,则:
①P与非羟基O之间的共价键的形成方式是
②中和20mL0.1mol?L-1次磷酸(H3PO2)溶液需要0.1mol?L-1 NaOH溶液的体积恰好为 20mL,则H3PO2的结构式是
(4)Zn2+基态时的电子排布式是
考点:极性分子和非极性分子,原子核外电子排布,共价键的形成及共价键的主要类型,原子轨道杂化方式及杂化类型判断
专题:
分析:(1)原子的电负性越大,其吸引电子的能力越强,则形成的极性键极性越强;
(2)根据价层电子对互斥理论确定N原子杂化方式;
(3)①P原子提供孤对电子O原子提供空轨道形成配位键;
②中和20mL 0.1mol/L次磷酸(H3PO2)溶液需要O.1mo/L NaOH溶液的体积恰好为20mL,则二者的物质的量之比为1:1,说明次磷酸是一元酸;
(4)Zn离子核外有28个电子,根据构造原理书写其离子核外电子排布式;离子晶体中离子半径越小、离子所带电荷越多其晶格能越大,晶格能越大,晶体的熔点越高.
(2)根据价层电子对互斥理论确定N原子杂化方式;
(3)①P原子提供孤对电子O原子提供空轨道形成配位键;
②中和20mL 0.1mol/L次磷酸(H3PO2)溶液需要O.1mo/L NaOH溶液的体积恰好为20mL,则二者的物质的量之比为1:1,说明次磷酸是一元酸;
(4)Zn离子核外有28个电子,根据构造原理书写其离子核外电子排布式;离子晶体中离子半径越小、离子所带电荷越多其晶格能越大,晶格能越大,晶体的熔点越高.
解答:
解:(1)原子的电负性越大,其吸引电子的能力越强,则形成的极性键极性越强,N电负性大于P,所以极性较大的是NH3,故答案为:NH3;N的电负性大于P;
(2)NH4N03中铵根离子中N原子价层电子对个数是4、硝酸根离子中N原子价层电子对个数是3,所以N原子杂化方式为sp3杂化、sp2杂化,故答案为:sp3杂化、sp2杂化;
(3)①P原子含有孤对电子,O元素含有空轨道,则P原子提供孤对电子O原子提供空轨道形成配位键,
故答案为:P原子提供孤对电子O原子提供空轨道形成配位键;
?②中和20mL 0.1mol/L次磷酸(H3PO2)溶液需要O.1mo/L NaOH溶液的体积恰好为20mL,则二者的物质的量之比为1:1,说明次磷酸是一元酸,即该分子中含有一个羟基,结构为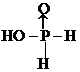 ,
,
故答案为: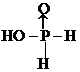 ;
;
(4)Zn离子核外有28个电子,根据构造原理知其离子核外电子排布式为[Ar]3d10;离子晶体中离子半径越小、离子所带电荷越多其晶格能越大,晶格能越大,晶体的熔点越高,同属于离子晶体,O2-半径小于S2-,故ZnO晶格能大(或离子键强),熔点高,
故答案为:1s22s22p63s23p63d10;ZnO;同属于离子晶体,O2-半径小于S2-,故ZnO晶格能大(或离子键强),熔点高.
(2)NH4N03中铵根离子中N原子价层电子对个数是4、硝酸根离子中N原子价层电子对个数是3,所以N原子杂化方式为sp3杂化、sp2杂化,故答案为:sp3杂化、sp2杂化;
(3)①P原子含有孤对电子,O元素含有空轨道,则P原子提供孤对电子O原子提供空轨道形成配位键,
故答案为:P原子提供孤对电子O原子提供空轨道形成配位键;
?②中和20mL 0.1mol/L次磷酸(H3PO2)溶液需要O.1mo/L NaOH溶液的体积恰好为20mL,则二者的物质的量之比为1:1,说明次磷酸是一元酸,即该分子中含有一个羟基,结构为
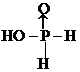 ,
,故答案为:
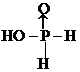 ;
;(4)Zn离子核外有28个电子,根据构造原理知其离子核外电子排布式为[Ar]3d10;离子晶体中离子半径越小、离子所带电荷越多其晶格能越大,晶格能越大,晶体的熔点越高,同属于离子晶体,O2-半径小于S2-,故ZnO晶格能大(或离子键强),熔点高,
故答案为:1s22s22p63s23p63d10;ZnO;同属于离子晶体,O2-半径小于S2-,故ZnO晶格能大(或离子键强),熔点高.
点评:本题考查物质结构和性质,涉及共价键的极性、核外电子排布式的书写、原子杂化方式的判断等知识点,这些都是考试热点,侧重于基础知识的综合应用的考查,题目难度中等.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
取两份铝片,第一份与足量硫酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,则两份铝片的质量之比为( )
| A、2:3 | B、1:1 |
| C、3:2 | D、1:3 |
 一种碳纳米管(氢气)二次电池原理如图.该电池的电解质为6moI/L KOH溶液,下列说法正确的是( )
一种碳纳米管(氢气)二次电池原理如图.该电池的电解质为6moI/L KOH溶液,下列说法正确的是( )| A、储存H2的碳纳米管放电时为负极,充电时为阳极 |
| B、充电时阳极反应为NiO(OH)+H2O+e-=Ni(OH)2+OH- |
| C、放电时正极附近溶液的pH减小 |
| D、放电时负极反应为H2+2OH--2e-=2H2O |
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )
| A、在自然界中只以化合态的形式存在 |
| B、单质常用作半导体材料和光导纤维 |
| C、最高价氧化物不与任何酸反应 |
| D、气态氢化物很稳定,受热不易分解 |
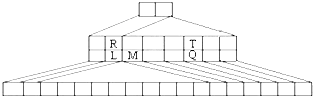 如图是另一种元素周期表--三角形元素周期表的一部分,图中标示了L、M、Q、R、T元素的位置,下列判断正确的是:( )
如图是另一种元素周期表--三角形元素周期表的一部分,图中标示了L、M、Q、R、T元素的位置,下列判断正确的是:( )| A、Q、T两元素的氢化物的稳定性为HnT<HnQ |
| B、L、R的单质与盐酸反应速率为R>L |
| C、M与T形成的化合物有两性 |
| D、L、Q形成的简单离子核外电子数相等 |
1L稀硝酸和稀硫酸的混合溶液,其溶质的物质的量浓度分别为0.1mol/L 和0.4mol/L.若向该混合溶液中加入足量的铜粉.则最多能溶解铜粉的质量为( )
| A、2.4 g |
| B、3.2 g |
| C、6.4 g |
| D、9.6 g |
下列说法不正确的是( )
①形成化学键的过程一定是化学变化
②离子化合物中一定含有金属元素
③物质有阳离子必有阴离子
④含有金属元素的离子一定为阳离子
⑤单质中一定含有共价键
⑥干冰升华破坏化学键
⑦HCI溶于水中电离出H+和Cl-,因此HCl中含有离子键.
①形成化学键的过程一定是化学变化
②离子化合物中一定含有金属元素
③物质有阳离子必有阴离子
④含有金属元素的离子一定为阳离子
⑤单质中一定含有共价键
⑥干冰升华破坏化学键
⑦HCI溶于水中电离出H+和Cl-,因此HCl中含有离子键.
| A、①②③④⑤⑥⑦ |
| B、②③④⑤⑥⑦ |
| C、③⑤⑥⑦ |
| D、①②③④⑤⑥ |
设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、78g Na2O2与足量水充分反应时电子转移数为NA |
| B、25℃、101.3kPa时,11.2L H2中含有的原子数为NA |
| C、标况下1 mol H2O的体积约为22.4L |
| D、2L 1mol/L Na2SO4溶液中离子总数为3NA |
