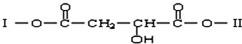题目内容
在地球上,氦元素主要以42He的形式存在,下列说法正确的是( )
| A、42He原子核内含有4个质子 |
| B、32He和42He互为同位素 |
| C、32He原子核内含有3个中子 |
| D、32He和42He是同一种核素 |
考点:质量数与质子数、中子数之间的相互关系,同位素及其应用
专题:原子组成与结构专题
分析:元素符号的左上角数字表示质量数,左下角数字表示质子数,中子数=质量数-质子数,质子数=核外电子数;质子数相同,中子数不同的原子互称为同位素.
解答:
解:A.42He代表原子核内有2个质子和2个中子的氦原子,故A错误;
B.32He与42He质子数相同都为2,中子数分别为1、2,互为是同位素,故B正确;
C.32He原子核内质子数为2,质量数为3,中子数为1,故C错误;
D.32He和42He质子数相同都为2,中子数分别为1、2,是同种元素的不同核素,故D错误;
故选B.
B.32He与42He质子数相同都为2,中子数分别为1、2,互为是同位素,故B正确;
C.32He原子核内质子数为2,质量数为3,中子数为1,故C错误;
D.32He和42He质子数相同都为2,中子数分别为1、2,是同种元素的不同核素,故D错误;
故选B.
点评:本题主要考查了原子符号的含义、同位素的概念,难度不大,明确概念是解答本题关键.

练习册系列答案
相关题目
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )
| A、在自然界中只以化合态的形式存在 |
| B、单质常用作半导体材料和光导纤维 |
| C、最高价氧化物不与任何酸反应 |
| D、气态氢化物很稳定,受热不易分解 |
1L稀硝酸和稀硫酸的混合溶液,其溶质的物质的量浓度分别为0.1mol/L 和0.4mol/L.若向该混合溶液中加入足量的铜粉.则最多能溶解铜粉的质量为( )
| A、2.4 g |
| B、3.2 g |
| C、6.4 g |
| D、9.6 g |
下列说法不正确的是( )
①形成化学键的过程一定是化学变化
②离子化合物中一定含有金属元素
③物质有阳离子必有阴离子
④含有金属元素的离子一定为阳离子
⑤单质中一定含有共价键
⑥干冰升华破坏化学键
⑦HCI溶于水中电离出H+和Cl-,因此HCl中含有离子键.
①形成化学键的过程一定是化学变化
②离子化合物中一定含有金属元素
③物质有阳离子必有阴离子
④含有金属元素的离子一定为阳离子
⑤单质中一定含有共价键
⑥干冰升华破坏化学键
⑦HCI溶于水中电离出H+和Cl-,因此HCl中含有离子键.
| A、①②③④⑤⑥⑦ |
| B、②③④⑤⑥⑦ |
| C、③⑤⑥⑦ |
| D、①②③④⑤⑥ |
设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、78g Na2O2与足量水充分反应时电子转移数为NA |
| B、25℃、101.3kPa时,11.2L H2中含有的原子数为NA |
| C、标况下1 mol H2O的体积约为22.4L |
| D、2L 1mol/L Na2SO4溶液中离子总数为3NA |
能够鉴别溶液和胶体的方法是( )
| A、过滤 | B、观察颜色及状态 |
| C、利用丁达尔效应 | D、萃取 |
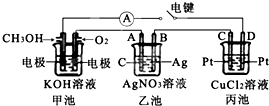 某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题:
某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题: