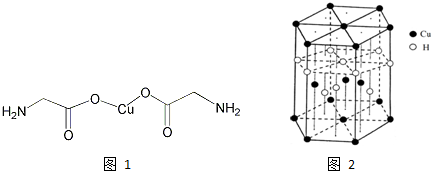
题目内容
5.下列图象错误的是( ) | 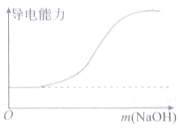 |
| A.向100mL 0.1mol•L-1H2SO4溶液中滴加 0.1mol•L-1Ba(OH)2溶液至过量 | B.向100mL 0.1mol•L-1H2SO4溶液中加入NaOH固体 |
 |  |
| C.向一定浓度的氯化钠溶液中加水 | D.向蒸馏水中通入HCl气体 |
| A. | A | B. | B | C. | C | D. | D |
分析 水溶液要想导电必须具有自由移动的带电微粒,带电微粒越多越容易导电,据此进行分析;
A.向H2SO4溶液中滴加Ba(OH)2溶液至过量,由于发生了反应Ba(OH)2+H2SO4=BaSO4↓+2H2O,随着Ba(OH)2溶液的滴加,离子的浓度逐渐降低,导电能力逐渐降低,最后导电能力为0,也就是说恰好完全反应没有自由移动的离子,再滴加Ba(OH)2溶液,离子的浓度逐渐增加,导电能力逐渐增加;
B.向H2SO4溶液中加NaOH固体,由于发生了反应2NaOH+H2SO4=Na2SO4↓+2H2O,离子的浓度不变,故导电能力不变,最后导电能力为0,再加NaOH,离子的浓度逐渐增加,导电能力逐渐增加;
C.向一定浓度的氯化钠溶液中加水,氯化钠的浓度越来越小,故导电能力越来越小,但不为0;
D.向蒸馏水中通入HCl气体,刚开始无自由移动离子,故导电能力为0,随着HCl气体的通入,离子的浓度逐渐增加,导电能力逐渐增加.
解答 解:A.向H2SO4溶液中滴加Ba(OH)2溶液至过量,由于发生了反应Ba(OH)2+H2SO4=BaSO4↓+2H2O,随着Ba(OH)2溶液的滴加,离子的浓度逐渐降低,导电能力逐渐降低,最后导电能力为0,也就是说恰好完全反应没有自由移动的离子,再滴加Ba(OH)2溶液,离子的浓度逐渐增加,导电能力逐渐增加,故图象最低点为0与x轴相切,故A错误;
B.向H2SO4溶液中加NaOH固体,由于发生了反应2NaOH+H2SO4=Na2SO4↓+2H2O,离子的浓度不变,故导电能力不变,最后导电能力为0,再加NaOH,离子的浓度逐渐增加,导电能力逐渐增加,故B正确;
C.向一定浓度的氯化钠溶液中加水,氯化钠的浓度越来越小,故导电能力越来越小,但不为0,故C正确;
D.向蒸馏水中通入HCl气体,刚开始无自由移动离子,故导电能力为0,随着HCl气体的通入,离子的浓度逐渐增加,导电能力逐渐增加,故D正确;
故选A.
点评 本题属于图象题,解题的关键是知道水溶液要想导电必须具有自由移动的带电微粒,带电微粒越多越容易导电,本题难度中等.

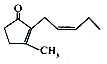
| A. | 茉莉酮易溶于水 | |
| B. | 茉莉酮中含有两种官能团 | |
| C. | 茉莉酮可与溴水、酸性KMnO4溶液发生加成反应,现象均为褪色 | |
| D. | 茉莉酮与二氢茉莉酮 互为同分异构体 互为同分异构体 |
| A. | v(A)=2 mol•L-1•min-1 | B. | v(B)=1.2 mol•L-1•s-1 | ||
| C. | v(D)=0.4 mol•L-1•min-1 | D. | v(C)=0.1 mol•L-1•s-1 |
| A. | 用分液漏斗分离乙醇和乙酸乙酯的混合物 | |
| B. | 新制氯水或浓硝酸存放在带橡皮塞的棕色玻璃瓶中 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 加热蒸发NaCl溶液时应用玻璃棒不断搅拌 |
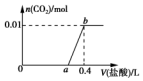 向NaOH和Na2CO3混合溶液中滴加0.1mol•L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是 ( )
向NaOH和Na2CO3混合溶液中滴加0.1mol•L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是 ( )| A. | 在0~a范围内,只发生NaOH和HCl的反应 | |
| B. | ab段发生反应的离子方程式为:CO32-+2H+═CO2↑+H2O | |
| C. | a=0.3 | |
| D. | 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2 |
(2)如图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化.每个小黑点代表一种氢化物,其中a点代表的是SiH4.
(3)化合物(CH3)3N与盐酸反应生成【(CH3)3 NH】+,该过程新生成的化学键为b.(填序号)
a.离子键 b.配位键 c.氢键 d.非极性共价键
若化合物(CH3)3N能溶于水,试解析其原因化合物(CH3)3N为极性分子且可与水分子间形成氢键
(4)CO2在高温高压下所形成的晶体其晶胞如图3所示.该晶体的熔点比SiO2晶体高(选填“高”或“低”),该晶体中碳原子轨道的杂化类型为sp3.
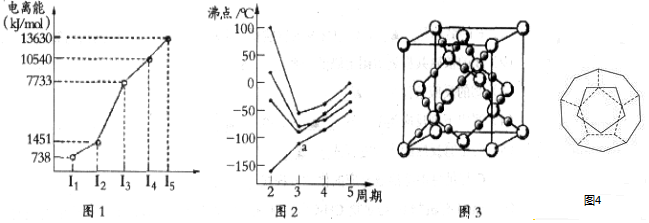
(5)如图4为20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图.C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;
则:C20分子共有12个正五边形,共有30条棱边.
(6)Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律.试推断Ni2+的水合离子为有(填“有”或“无”)色离子,依据是Ni2+的3d轨道上有未成对电子.
| 离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
| 颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |