题目内容
将n mol的Cu2S与足量稀HNO3反应,生成Cu(NO3)2、H2SO4、NO和H2O,则参加反应的HNO3中被还原的HNO3的物质的量是( )
| A、4n mol | ||
| B、10n mol | ||
C、
| ||
D、
|
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:反应中Cu元素化合价由+1价升高为+2价,S元素有-2价升高为+6价,反应中只有N元素被还原,N元素的化合价由+5价降低为+2价,令被还原的硝酸的物质的量为xmol,根据电子转移守恒列方程计算x的值.
解答:
解:反应中Cu元素化合价由+1价升高为+2价,S元素有-2价升高为+6价,反应中只有N元素被还原,N元素的化合价由+5价降低为+2价,令被还原的硝酸的物质的量为xmol,根据电子转移守恒有nmol×[2×(2-1)+6-(-2)]=xmol×(5-2),解得x=
n.
故选D.
| 10 |
| 3 |
故选D.
点评:本题考查氧化还原反应的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,难度中等,注意氧化还原反应中电子转移守恒运用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列离子方程式正确的是( )
| A、氢氧化钡溶液中滴加少量稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| B、次氯酸钙溶液中通入过量二氧化碳:ClO-+H2O+CO2=HCO3-+HClO |
| C、向碳酸氢钠溶液中滴入过量澄清石灰水:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O |
| D、NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O |
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、1L浓度为0.1mol/L AlCl3溶液中含有的离子数是0.4NA |
| B、3.9g Na2O2吸收足量的CO2时转移的电子数是0.05NA |
| C、标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1NA |
| D、标准状况下,1.12L的SO3所含的原子数是0.2NA |
为了有效除去工业食盐中的Ca2+、Mg2+、SO42-,加入试剂的合理顺序为( )
| A、NaOH-Na2CO3-BaCl2 |
| B、NaOH-BaCl2-Na2CO3 |
| C、BaCl2-NaOH-Na2CO3 |
| D、Na2CO3-BaCl2-NaOH |
关于氨气的喷泉实验的说法不正确的是( )
| A、NH3用水做成喷泉实验,说明NH3易溶于水 |
| B、用标况下的NH3做成喷泉实验的烧瓶中的溶液的物质的量的浓度可以求出 |
| C、实验时,NH3越纯,效果越好 |
| D、若实验不成功,说明NH3不易溶于水 |
 将一定质量的镁和铝的混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示,则下列说法不正确的是
将一定质量的镁和铝的混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示,则下列说法不正确的是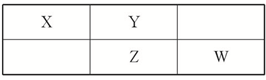 四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍. 短周期元素R、Q、M、T在元素周期表中的相对位置如下表,已知R原子最外层电子数与次外层电子数之比为2:1.
短周期元素R、Q、M、T在元素周期表中的相对位置如下表,已知R原子最外层电子数与次外层电子数之比为2:1.
 的系统命名
的系统命名