题目内容
设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A、16g O2中含有的氧原子数为NA |
| B、只有在标准状况下,NA个H2的体积才是22.4L |
| C、1mol Fe与足量Cl2反应转移的电子数为2NA |
| D、1mol?L-1 CuSO4溶液中含有的Cu2+数目为NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、依据n=
计算物质的量,结合分子式计算原子数;
B、NA个H2的物质的量为1mol,温度压强一定体积可能是22.4L;
C、1mol Fe与足量Cl2反应,生成氯化铁,依据反应的铁计算转移的电子数;
D、溶液体积不知不能计算微粒数.
| m |
| M |
B、NA个H2的物质的量为1mol,温度压强一定体积可能是22.4L;
C、1mol Fe与足量Cl2反应,生成氯化铁,依据反应的铁计算转移的电子数;
D、溶液体积不知不能计算微粒数.
解答:
解:A、依据n=
计算物质的量=
=0.5mol,结合分子式计算原子数,16g O2中含有的氧原子数为NA,故A正确;
B、NA个H2的物质的量为1mol,温度压强一定体积可能是22.4L,依据PV=nRT分析判断,故B错误;
C、1mol Fe与足量Cl2反应,生成氯化铁,依据反应的铁计算转移的电子数为3NA,故C错误;
D、溶液体积不知不能计算微粒数,故D错误;
故选A.
| m |
| M |
| 16g |
| 32g/mol |
B、NA个H2的物质的量为1mol,温度压强一定体积可能是22.4L,依据PV=nRT分析判断,故B错误;
C、1mol Fe与足量Cl2反应,生成氯化铁,依据反应的铁计算转移的电子数为3NA,故C错误;
D、溶液体积不知不能计算微粒数,故D错误;
故选A.
点评:本题考查了阿伏伽德罗常数的分析判断,主要是气体摩尔体积的条件应用,氧化还原反应电子转移计算,掌握基础是关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列元素中,属于p区元素的是( )
| A、H | B、O | C、Fe | D、Mg |
下列化学措施不可行的是( )
| A、工业电解熔融Al203冶炼Al |
| B、用浸有KMn04溶液的硅土吸收水果释放的乙烯 |
| C、使用催化剂改变工业合成NH3的日产量 |
| D、蔗糖及其水解产物均可发生银镜反应 |
下列化学用语或者说法正确的是( )
| A、2mol SO2气体与足量的O2在一定条件下反应,转移的电子数为4×6.02×1023 |
B、铵根离子的结构式: |
| C、谷氨酸的熔点高达205℃,主要是因为晶体中羧基与氨基之间形成较强的氢键 |
| D、常温下,100mL pH=1的硫酸溶液中含有的H+离子数为0.01×6.02×1023 |


 将一定质量的镁和铝的混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示,则下列说法不正确的是
将一定质量的镁和铝的混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示,则下列说法不正确的是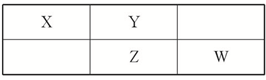 四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.