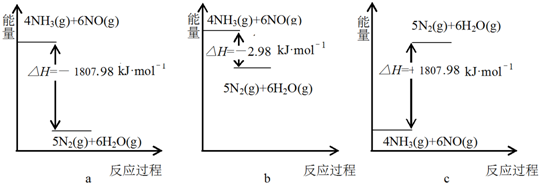
题目内容
12.已知反应:①101kPa时,2C(s)+O 2(g)═2CO(g)△H=-221kJ•mol-1②稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1下列结论正确的是( )
| A. | 碳的燃烧热大于110.5 kJ•mol-1 | |
| B. | ①的反应热为221 kJ•mol-1 | |
| C. | 浓硫酸与稀NaOH溶液反应的成1 mol水,放出57.3 kJ热量 | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
分析 A、CO燃烧生成二氧化碳继续放出热量;
B、反应热包含符号,①的反应热为-221 kJ•mol-1;
C、浓硫酸溶解过程中放热;
D、醋酸是弱电解质,电离需吸收热量.
解答 解:A、由反应①可知,1mol碳燃烧生成CO放出的热量为110.5 kJ,CO燃烧生成二氧化碳继续放出热量,故1mol碳完全燃烧放出的热量大于110.5 kJ,所以碳的燃烧热大于110.5 kJ/mol,故A正确;
B、反应热包含符号,①的反应热为-221 kJ•mol-1,故B错误;
C、浓硫酸溶于水放热,所以放出的热量大于57.3 kJ,所以浓硫酸与氢氧化钠溶液反应,放出热量大于57.3 kJ,故C错误;
D、醋酸是弱电解质,电离需吸收热量,稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量小于57.3 kJ,故D错误;
故选A.
点评 本题考查学生对于反应热、中和热的理解及有关计算等,难度不大,注意稀的强酸、强碱的中和热为△H=-57.3kJ/mol.

练习册系列答案
相关题目
18.下列物质中既能与稀硫酸反应,又能与氢氧化钠溶液反应是( )
①NaHCO3 ②Na2CO3 ③Al2O3 ④Al ⑤Al (OH)3.
①NaHCO3 ②Na2CO3 ③Al2O3 ④Al ⑤Al (OH)3.
| A. | ③④ | B. | ①③④⑤ | C. | ③④⑤ | D. | 全部 |
3.81号元素所在周期和族是( )
| A. | 第六周期ⅣA族 | B. | 第六周期ⅢB族 | C. | 第七周期0族 | D. | 第六周期ⅢA族 |
20.现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产生下列离子(各离子不重复).
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性;
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀;
④上述沉淀包括难溶物和微溶物.
试回答下列问题:
(1)A溶液呈碱性的原因是CO32-+H2O?HCO3-+OH-(用离子方程式表示);
(2)D是AgNO3溶液,E是Al2(SO4)3溶液(均写化学式).
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀;
④上述沉淀包括难溶物和微溶物.
试回答下列问题:
(1)A溶液呈碱性的原因是CO32-+H2O?HCO3-+OH-(用离子方程式表示);
(2)D是AgNO3溶液,E是Al2(SO4)3溶液(均写化学式).
17.将①H+、②NH4+、③NO3-、④K+、⑤CO32-、⑥OH-分别加入H2O中,基本上不影响水的电离平衡的是( )
| A. | ③④ | B. | ②③⑥ | C. | ①⑥ | D. | ②④ |
1.若NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | NA个Fe(OH)3胶体粒子的质量为107g | |
| B. | 8.0gCu2S和CuO的混合物中含有铜原子数为0.1NA | |
| C. | 标准状况下,将2.24L Cl2溶于水,可得到HClO分子的数目是0.1NA | |
| D. | 5.6gFe与0.1mol Cl2完全反应,反应中转移的电子数为0.3NA |
2.下列关于中和热测定实验的叙述正确的是( )
| A. | 为使反应充分进行,应将盐酸分次加入碱液中 | |
| B. | 为使反应刚好完全进行,应使用浓度和体积相同的NaOH和HCl溶液 | |
| C. | 测量初始温度时,测量盐酸后需清洗温度计再测量NaOH溶液温度 | |
| D. | 如无玻璃环形搅拌棒,可利用铁丝或铜丝代替 |