题目内容
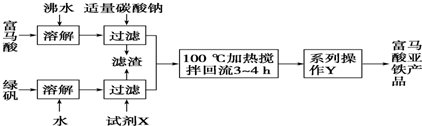
从固体混合物A出发可以发生如框图所示的一系列变化:

(1)在实验室中常用反应①制取气体C.若要收集气体C,可选择如图1装置中的 (填字母)

(2)操作②的名称是 ,在操作②中所使用的玻璃仪器的名称是 .
(3)写出下列反应的方程式:
反应①的化学方程式
反应③的化学方程式
(4)在实验室中,要获得干燥纯净的黄绿色气体F,可以将它通过图2中的装置,其中瓶I中盛放的是 ,瓶II中盛放的是 .

(1)在实验室中常用反应①制取气体C.若要收集气体C,可选择如图1装置中的

(2)操作②的名称是
(3)写出下列反应的方程式:
反应①的化学方程式
反应③的化学方程式
(4)在实验室中,要获得干燥纯净的黄绿色气体F,可以将它通过图2中的装置,其中瓶I中盛放的是
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:F为黄绿色气体,则F为Cl2,反应③为二氧化锰与浓盐酸的反应,则D为MnO2,I为HCl,E电解生成氯气、氢气和氢氧化钾,则G为氢气,HCl与氢氧化钾反应生成KCl,则E为KCl,混合物B为MnO2、KCl的混合物,则反应①为2KClO3
2KCl+3O2↑,A为KClO3,催化剂为MnO2,气体C为O2,
(1)根据氧气的物理性质分析;
(2)根据分离固体和液体的操作分析;
(3)根据流程分析判断发生的反应;
(4)根据氯气中的杂质分析.
| ||
| △ |
(1)根据氧气的物理性质分析;
(2)根据分离固体和液体的操作分析;
(3)根据流程分析判断发生的反应;
(4)根据氯气中的杂质分析.
解答:
解:F为黄绿色气体,则F为Cl2,反应③为二氧化锰与浓盐酸的反应,则D为MnO2,I为HCl,E电解生成氯气、氢气和氢氧化钾,则G为氢气,HCl与氢氧化钾反应生成KCl,则E为KCl,混合物B为MnO2、KCl的混合物,则反应①为2KClO3
2KCl+3O2↑,A为KClO3,催化剂为MnO2,气体C为O2,
(1)氧气不溶于水,可选A用排水法收集,氧气的密度比空气的大,可选C用向上排空气法收集,
故答案为:AB;
(2)B为MnO2、KCl的混合物,KCl溶于水,而MnO2不溶于水,可利用过滤来分离,过滤操作使用的玻璃仪器为漏斗、玻璃棒、烧杯;
故答案为:过滤;漏斗、玻璃棒、烧杯;
(3)反应①的化学方程式为2KClO3
2KCl+3O2↑,反应④的离子反应为MnO2+2Cl-+4H+═Mn2++Cl2↑+2H2O,
故答案为:2KClO3
2KCl+3O2↑;MnO2+2Cl-+4H+═Mn2++Cl2↑+2H2O;
(4)要获得干燥纯净的黄绿色气体氯气,瓶Ⅰ中盛放饱和食盐水抑制氯气的溶解同时除去混有的杂质HCl,在瓶Ⅱ中盛放浓H2SO4干燥即可,
故答案为:饱和食盐水;浓H2SO4.
| ||
| △ |
(1)氧气不溶于水,可选A用排水法收集,氧气的密度比空气的大,可选C用向上排空气法收集,
故答案为:AB;
(2)B为MnO2、KCl的混合物,KCl溶于水,而MnO2不溶于水,可利用过滤来分离,过滤操作使用的玻璃仪器为漏斗、玻璃棒、烧杯;
故答案为:过滤;漏斗、玻璃棒、烧杯;
(3)反应①的化学方程式为2KClO3
| ||
| △ |
故答案为:2KClO3
| ||
| △ |
(4)要获得干燥纯净的黄绿色气体氯气,瓶Ⅰ中盛放饱和食盐水抑制氯气的溶解同时除去混有的杂质HCl,在瓶Ⅱ中盛放浓H2SO4干燥即可,
故答案为:饱和食盐水;浓H2SO4.
点评:本题考查无机物的推断,利用物质的性质及发生的反应推断出各物质是解答本题的关键,题目难度中等,熟悉氧气的制法、氯气的制法及氯气的性质即可解答.

练习册系列答案
相关题目
NA为阿伏加德罗常数,下列有关说法中不正确的是( )
| A、标准状况下,22.4 L氦气含有NA个氦原子 |
| B、20 g重水含有10 NA个电子 |
| C、12.5 mL l6 mol?L-1浓硫酸与足量铜反应,转移电子数为0.2 NA |
| D、1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1 NA |
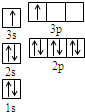 A、B、C、D、E都是周期表中前四周期的元素.已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大.B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区.C元素原子的外围电子层排布式为nsn-1npn-1. D原子M能层为全充满状态,且最外层无成对电子,E为第四周期未成对电子数最多的元素.请回答下列问题:
A、B、C、D、E都是周期表中前四周期的元素.已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大.B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区.C元素原子的外围电子层排布式为nsn-1npn-1. D原子M能层为全充满状态,且最外层无成对电子,E为第四周期未成对电子数最多的元素.请回答下列问题: )是一种限量使用的铁强化剂.
)是一种限量使用的铁强化剂.