题目内容
7.固体D是一种红色氧化物.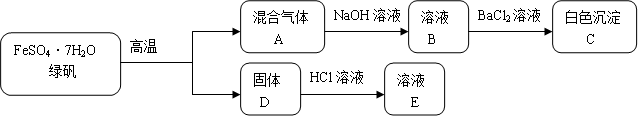
(1)混合气体A通入足量NaOH溶液后,溶液B中属于盐的溶质有Na2SO3;Na2SO4.
(2)白色沉淀C中加入盐酸的实验现象为沉淀部分溶解且有气体生成.
(3)固体D与HCl溶液反应的离子方程式为Fe2O3+6H+=2Fe3++3H2O.
分析 FeSO4•7H2O高温分解得到固体D,固体D是一种红色氧化物为铁的氧化物判断为Fe2O3,溶于盐酸溶液得到E溶液为氯化铁溶液,混合气体A通入氢氧化钠溶液得到溶液B,加入氯化钡生成白色沉淀C为BaSO4,则A中含有SO3,结合盐酸化合价变化可知铁元素化合价升高,硫元素化合价降低,所以A气体中一定含有SO2,杯水沉淀中还有BaSO3,
(1)分析可知B溶液中含有硫酸钠和亚硫酸钠;
(2)白色沉淀C中加入盐酸,亚硫酸钡和盐酸溶解生成二氧化硫气体;
(3)固体D为氧化铁和盐酸反应生成氯化铁溶液.
解答 解:FeSO4•7H2O高温分解得到固体D,固体D是一种红色氧化物为铁的氧化物判断为Fe2O3,溶于盐酸溶液得到E溶液为氯化铁溶液,混合气体A通入氢氧化钠溶液得到溶液B,加入氯化钡生成白色沉淀C为BaSO4,则A中含有SO3,结合盐酸化合价变化可知铁元素化合价升高,硫元素化合价降低,所以A气体中一定含有SO2,杯水沉淀中还有BaSO3,
(1)分析可知,混合气体A通入足量NaOH溶液后,溶液B中属于盐的溶质有硫酸钠和亚硫酸钠,化学式为:Na2SO3; Na2SO4,
故答案为:Na2SO3; Na2SO4;
(2)白色沉淀C中加入盐酸,亚硫酸钡和盐酸溶解生成二氧化硫气体,反应的现象为沉淀部分溶解且有气体生成,
故答案为:沉淀部分溶解且有气体生成;
(3)固体D为氧化铁和盐酸反应生成氯化铁溶液,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,
故答案为:Fe2O3+6H+=2Fe3++3H2O.
点评 本题考查了物质性质、物质转化、物质反应的特征现象等知识,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
18.基于实验现象的推论,你认为合理的是( )
| 选项 | 实验现象 | 推论 |
| A | 乙烯气体可以使溴水褪色 | 乙烯发生取代反应 |
| B | 浓硫酸电导率比较低 | 硫酸浓度大时是弱电解质 |
| C | 氨气用于喷泉实验 | 氨气极易溶于水 |
| D | 硝酸溶液使pH试纸先变红后变白 | 硝酸酸性太强不能用pH试纸检测 |
| A. | A | B. | B | C. | C | D. | D |
15.光纤通讯是光导纤维传送信号的一种通讯手段,合成光导纤维及氮化硅(一种无机涂层)的工艺流程如图:

回答下列问题:
(1)反应I的化学方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,氧化剂为SiO2(填化学式).
(2)经反应II所得的四氯化硅粗品中所含的物质如表:
图中“操作X”的名称为精馏(或蒸馏);PCl3的电子式为 .
.
(3)反应III和IV中尾气的用途为制取盐酸;反应IV的化学方程式为3SiCl4+4NH3$\frac{\underline{\;1400℃\;}}{\;}$Si3N4+12HCl.

回答下列问题:
(1)反应I的化学方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,氧化剂为SiO2(填化学式).
(2)经反应II所得的四氯化硅粗品中所含的物质如表:
| 组分名称 | SiCl4 | SiHCl3 | SiH2Cl2 | HCl | BCl3 | PCl3 |
| 质量分数 | 0.545 | 0.405 | 0.0462 | 0.0003 | 0.00193 | 0.00157 |
| 沸点/℃ | 57.6 | 31.8 | 8.2 | -85 | 12.5 | 75.5 |
 .
.(3)反应III和IV中尾气的用途为制取盐酸;反应IV的化学方程式为3SiCl4+4NH3$\frac{\underline{\;1400℃\;}}{\;}$Si3N4+12HCl.
2.下列表述正确的是( )
| A. | 硫离子的结构示意图: | B. | 乙烯的结构简式为CH2CH2 | ||
| C. | 过氧化氢的电子式: | D. | H2O分子的比例模型 |
1.用太阳能电解水可获得最理想的单质燃料X,但运输极不方便,国外试用了如下的方法把X转变成便于运输的甲醇燃料;将空气通过极浓的NaOH溶液中,此时空气中的Y有70%被吸收,转变为正盐Z,当Z达到饱和后即加入硫酸,此时溶液会放出纯净的气体Y.一定条件下通过X与Y反应生成甲醇.试回答以下问题:
(1)Z是Na2CO3(写化学式),X和Y反应的化学方程式为CO2+3H2=CH3OH+H2O.
(2)在120℃,如下容积固定的密闭容器中,当活塞被固定在整个装置的中间,X与Y按(1)在Ⅰ中进行反应:
若活塞可左右自由滑动并且导热,起始时Ⅰ中X为n mol,Y为6.5 mol,CH3OH(g)和D各为2 m ol;Ⅱ中A、B、C各为4 mol.当 n 在一定范围内变化时,均可通过调节反应器的温度(Ⅰ和Ⅱ中温度始终相等),使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置.回答下列问题:
①若 n=2.5,则1中起始时反应向正反应(填“正反应”或“逆反应”)方向进行.欲使起始时反应向该方向进行,则 n 的取值范围是1.5<n<4.5.
②若 n 分别取3.0和4.0,则在这两种情况下,当反应分别达到平衡时,A的物质的量不相等(填“相等”或“不相等”),理由是温度不同.
(1)Z是Na2CO3(写化学式),X和Y反应的化学方程式为CO2+3H2=CH3OH+H2O.
(2)在120℃,如下容积固定的密闭容器中,当活塞被固定在整个装置的中间,X与Y按(1)在Ⅰ中进行反应:
| X(g)+Y(g)?CH3OH(g)+D(g) (未配平) | A(g)+B(g)?2C(g) |
①若 n=2.5,则1中起始时反应向正反应(填“正反应”或“逆反应”)方向进行.欲使起始时反应向该方向进行,则 n 的取值范围是1.5<n<4.5.
②若 n 分别取3.0和4.0,则在这两种情况下,当反应分别达到平衡时,A的物质的量不相等(填“相等”或“不相等”),理由是温度不同.
8.CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
(1)250℃时,以镍合金为催化剂,向4L容器中通入6mol CO2、6mol CH4,发生如下反应:CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分体积分数如表:
①此温度下该反应的平衡常数K=64.
②已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O (g)═CO2(g)+H2 (g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=+247.3kJ•mol-1
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.
①在不同温度下催化剂的催化效率与乙酸的生成速率如图1所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低.

②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强、增大CO2的浓度.
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
(3)Li2O、Na2O、MgO均能吸收CO2.①如果寻找吸收CO2的其他物质,下列建议合理的是ab.
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2.原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是CO2+Li4SiO4$?_{700℃}^{500℃}$Li2CO3+Li2SiO3.
(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品.
反应A:CO2+H2O$\frac{\underline{\;电解\;}}{高温}$CO+H2+O2
高温电解技术能高效实现(3)中反应A,工作原理示意图如图2:CO2在电极a放电的反应式是CO2+2e-═CO+O2-.
(1)250℃时,以镍合金为催化剂,向4L容器中通入6mol CO2、6mol CH4,发生如下反应:CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分体积分数如表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
②已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O (g)═CO2(g)+H2 (g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=+247.3kJ•mol-1
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.
①在不同温度下催化剂的催化效率与乙酸的生成速率如图1所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低.

②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强、增大CO2的浓度.
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
(3)Li2O、Na2O、MgO均能吸收CO2.①如果寻找吸收CO2的其他物质,下列建议合理的是ab.
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2.原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是CO2+Li4SiO4$?_{700℃}^{500℃}$Li2CO3+Li2SiO3.
(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品.
反应A:CO2+H2O$\frac{\underline{\;电解\;}}{高温}$CO+H2+O2
高温电解技术能高效实现(3)中反应A,工作原理示意图如图2:CO2在电极a放电的反应式是CO2+2e-═CO+O2-.
6.下列说法正确的是( )
| A. | 外加直流电源保护钢闸门时,钢闸门与电源的负极相连 | |
| B. | 铅蓄电池在放电过程中,负极质量增加,正极质量减少 | |
| C. | 锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 | |
| D. | t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,K值及SO2转化率不变 |



