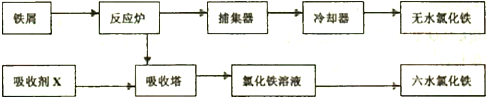
题目内容
1.(1)4g甲烷在氧气中燃烧生成CO2和液态水,放出222.5KJ热量,写出甲烷燃烧的热化学方程式CH4(g)+2O2(g)=CO2(g)+3H2O(l)△H=-890kJ/mol.(2)拆开1mol H-H键、1mol N-H键、1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则合成氨反应的热化学方程式为N2(g)+3H2(g)═2NH3(g)△H=-92kJ/mol.
(3)已知:H2(g)+$\frac{1}{2}$O2(g)═H2O (g)△H=-241.8KJ/mol;C (s)+O2(g)═CO2(g)△H=-393.5KJ/mol;现有0.2mol的炭粉和氢气组成的悬浮气,因混合物在氧气中完全燃烧,共放出63.53KJ热量,则混合物中C与H2的物质的量之比为1:1.
分析 (1)甲烷的物质的量为$\frac{4g}{16g/mol}$=0.25mol,则1mol甲烷在氧气中燃烧生成CO2和液态水,放出热量为222.5KJ×4=890kJ,焓变为负,结合物质的状态书写热化学方程式;
(2)焓变为反应物中键能之和减去生成物中键能之和,以此书写热化学方程式;
(3)设C与H2的物质的量分别为x、y,则
$\left\{\begin{array}{l}{x+y=0.2}\\{241.8x+393.5y=63.53}\end{array}\right.$,以此来解答.
解答 解:(1)甲烷的物质的量为$\frac{4g}{16g/mol}$=0.25mol,则1mol甲烷在氧气中燃烧生成CO2和液态水,放出热量为222.5KJ×4=890kJ,焓变为负,热化学方程为CH4(g)+2O2(g)=CO2(g)+3H2O(l)△H=-890kJ/mol,
故答案为:CH4(g)+2O2(g)=CO2(g)+3H2O(l)△H=-890kJ/mol;
(2)N2(g)+3H2(g)═2NH3 (g)△H=946kJ/mol+3×436kJ/mol-2×3×391kJ/mol=-92kJ/mol,热化学方程式为N2(g)+3H2(g)═2NH3 (g)△H=-92kJ/mol,故答案为:N2(g)+3H2(g)═2NH3 (g)△H=-92kJ/mol;
(3)设C与H2的物质的量分别为x、y,则
$\left\{\begin{array}{l}{x+y=0.2}\\{241.8x+393.5y=63.53}\end{array}\right.$,
解得x=y=0.1mol,
则混合物中C与H2的物质的量之比为0.1mol:0.1mol=1:1,
故答案为:1:1.
点评 本题考查反应热与焓变,为高频考点,把握热化学方程式的书写、反应中能量变化为解答的关键,侧重分析与应用能力的考查,注意物质的状态及热量与物质的量的关系,题目难度不大.

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案| A. | 2NA个H2与O2恰好反应,消耗氧气的体积约是22.4L | |
| B. | 1molC12与足量Fe反应,转移的电子数为3NA | |
| C. | 0.1molNaHSO4固体中,共含有0.2 NA个离子 | |
| D. | 在标准状况下,lLpH=13的NaOH溶液中,含有0.1NA个OH-(不考虑水的电离) |
| 温度 | 25℃ | 50℃ | 95℃ |
| 溶解度 | 0.17g | 0.95g | 6.8g |
某同学为了提纯某苯甲酸样品,进行了如下实验:
(1)室温时,取少量样品放入烧杯,加入100mL蒸馏水充分搅拌,发现样品几乎没溶解;将烧杯放在石棉网上加热,待样品充分溶解后,再加入少量蒸馏水,然后趁热过滤.趁热过滤的目的是滤除去不溶于水的杂质,并避免溶质因温度降低析出而造成损失;将所得滤液冷却至室温,使苯甲酸以晶体形式析出,然后过滤得到较纯净的苯甲酸晶体;
II.合成苯甲酸甲酯粗产品(已知部分物质的沸点如下表)
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 相对分子质量 | 34 | 122 | 136 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
(2)浓硫酸的作用是催化剂和吸水剂;若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式:C6H5-CO18OH+CH3OH?C6H5-COOCH3+H218O;
(3)甲和乙两位同学分别设计了如图1两套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).选择适当的装置(甲或乙),并说明你选择理由甲中有冷凝回流装置_;若要提高苯甲酸甲酯的产率,可采取的措施及时分离出产物苯甲酸甲酯(答案合理即可);(至少写出一条措施).
III.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程图如图2进行精制.
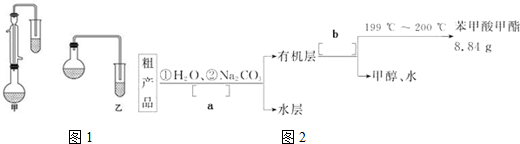
(4)以上流程图a、b所代表的实验操作为a:分液b:蒸馏;
(5)通过计算,苯甲酸甲酯的产率为65.0%(保留两位有效数字).
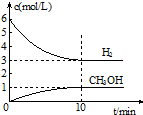 T℃时,在1L的密闭容器中充入2mol CO2和6mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.测得H2和CH3OH(g)的浓度随时间变化情况如图所示:下列说法不正确的是( )
T℃时,在1L的密闭容器中充入2mol CO2和6mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.测得H2和CH3OH(g)的浓度随时间变化情况如图所示:下列说法不正确的是( )| A. | 0~10min内v(H2)=0.3 mol•L-1•min-1 | |
| B. | T℃时,平衡常数K=$\frac{1}{27}$,CO2与H2的转化率相等 | |
| C. | T℃时,当有32 g CH3OH生成时,放出49.0 kJ的热量 | |
| D. | 达到平衡后,升高温度或再充入CO2气体,都可以提高H2的转化率 |
(1)选用的指示剂是甲基橙,滴定终点的颜色变化为甲基橙.
(2)某学生根据3次实验分别记录有关数据如表:
| 滴定次数 | 待测氨水溶液的体积/mL | 0.10mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(3)下列实验操作对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
A.观察酸式滴定管液面时,开始仰视,滴定终点平视,则滴定结果偏低.
B.若将锥形瓶用待测液润洗,然后再加入25.00mL待测液,则滴定结果偏高.
C.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失偏高
D.锥形瓶内溶液颜色出现变色,立即记下滴定管内液面所在刻度偏低
(4)若用0.10mol•L-1的盐酸滴定0.10mol•L-1的氨水,滴定过程中可能出现的结果是ABD
A.c(NH4+)>c(Cl-),c(OH-)>c(H+) B.c(NH4+)=c(Cl-),c(OH-)=c(H+)
C.c(Cl-)>c(NH4+),c(OH-)>c(H+) D.c(Cl-)>c(NH4+),c(H+)>c(OH-)
(5)若25℃时,将a mol/L的氨水与0.10mol/L的盐酸等体积混合,溶液中
c(NH4+ )=c(Cl-).则溶液显中性(填“酸”、“碱”或“中”);用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-8}}{a-0.1}$.
| A. | 若a+b<c+d,增大压强,则平衡向左移动 | |
| B. | 若从正反应开始,起始时A、B的物质的量之比为a:b,则平衡时A、B的转化率之比为a:b | |
| C. | 若a+b=c+d,在平衡体系中共有气体m mol,再向其中充入n mol B,则达到平衡时气体总物质的量小于(m+n)mol | |
| D. | 若a+b=c+d,则对于体积不变的容器,升高温度,平衡向左移动,容器中气体压强不变 |
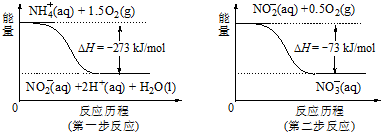
①第一步反应是放热反应(选题“放热”或“吸热”),判断依据是反应物的总能量大于生成物的总能量
②1mol NH4+(aq)全部氧化成NO3- (aq)的热化学方程式是NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol
(2)用酸式滴定管准确移取25.00mL某未知浓度的盐酸于一洁净的锥形瓶中,然后用0.20mol•L-1的氢氧化钠溶液(指示剂为酚酞)滴定,滴定结果如下:
| 实验编号 | NaOH起始读数 | NaOH终点读数 |
| 第一次 | 0.10mL | 18.40mL |
| 第二次 | 3.00mL | 21.10mL |
| 第三次 | 0.20mL | 20.40mL |
| 第四次 | 0.00mL | 18.20mL |
②判断滴定终点的现象是无色变粉红色,且半分钟内不变色
③根据以上数据可以计算出盐酸的物质的量浓度为0.15 mol•L-1(小数点后保留两位有效数字).
④以下操作可能造成测定结果偏高的是ACE(填写序号).
A.滴定前,碱式滴定管尖嘴有气泡,滴定后消失
B.滴定前读数正确,达到滴定终点后,俯视读数
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.盛装未知液的锥形瓶用蒸馏水洗后,未用待测液润洗
E.未用标准液润洗碱式滴定管
(3)由pH=3的HA(弱酸)与pH=11的NaOH溶液等体积混合,所得溶液中离子浓度大小的顺序为c(A-)>c(Na+)>c(H+)>c(OH-).