题目内容
11.由两种金属组成的混合物4.8g,跟氯气完全反应时,消耗氯气2.24L(标准状况),则混合物的组成可能是( )| A. | 镁和铁 | B. | 钠和铁 | C. | 钠和铝 | D. | 铁和铜 |
分析 假设都是+2价金属,标准状况下2.24L氯气的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,则混合金属平均摩尔质量为:$\frac{4.8g}{0.1mol}$=48g/mol,据此结合选项中金属组合进行判断,注意Na为+2价时的摩尔质量为46g/mol,铝为+2价的摩尔质量为$\frac{27g/mol}{3}$×2=18g/mol,铁与氯气反应生成氯化铁,则+2价时Fe的摩尔质量为:$\frac{56g/mol}{3}$×2≈37.3.
解答 解:假设金属都是+2价,标准状况下2.24L氢气的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,则混合金属评价摩尔质量为:$\frac{4.8g}{0.1mol}$=48g/mol,
A.Mg的摩尔质量为24g/mol,Fe的摩尔质量为56g/mol,铁与氯气反应生成氯化铁,则+2价时Fe的摩尔质量为:$\frac{56g/mol}{3}$×2≈37.3,二者+2时的平均摩尔质量可一定小于48g/mol,故A正确;
B.Na为+2价时的摩尔质量为46g/mol,铁与氯气反应生成氯化铁,则+2价时Fe的摩尔质量为:$\frac{56g/mol}{3}$×2≈37.3,二者的平均摩尔质量一定小于48g/mol,故B错误;
C.Na为+2价时的摩尔质量为46g/mol,铝为+2价的摩尔质量为$\frac{27g/mol}{3}$×2=18g/mol,二者的平均摩尔质量一定小于48g/mol,故C错误;
D.铁与氯气反应生成氯化铁,则+2价时Fe的摩尔质量为:$\frac{56g/mol}{3}$×2≈37.3,铜的摩尔质量为64g/mol,二者的平均摩尔质量可以为48g/mol,故D正确;
故选D.
点评 本题考查混合物的计算,题目难度中等,明确常见金属与氯气的反应实质为解答关键,注意掌握平均值法在化学计算中的应用,试题培养了学生的化学计算能力.

| A. | 发生反应:SO3+H2O+BaCl2═BaSO4↓+2HCl | |
| B. | 产生蓝色沉淀 | |
| C. | 有气体生成 | |
| D. | 若将SO2通入BaCl2溶液中,也会产生与SO3通入BaCl2溶液中相同的现象 |
| A. | 铝的活泼性差 | B. | 铝表面有致密的氧化膜 | ||
| C. | 铝与氧气不反应 | D. | 铝的还原性差 |
| A. | 常温常压下,48g O3含有的分子数为NA | |
| B. | 1molNa2O2晶体中阴离子数为2 NA | |
| C. | 标准状况下,33.6L的 四氯化碳(CCl4)中含有的碳原子数目为1.5NA | |
| D. | 常温常压下,7.1 g Cl2与足量的Fe充分反应,转移的电子数目为0.3 NA |
| A. | 原子半径由小到大排序为:X<Y<Z<W | |
| B. | Z的最高价氧化物既能与某酸反应,又能与某碱反应,属于两性物质 | |
| C. | Y单质在一定条件下可以跟四氧化三铁发生置换反应 | |
| D. | 室温下,0.1 mol•L-1 W的气态氢化物的水溶液中氢离子的浓度为0.2mol•L-1 |
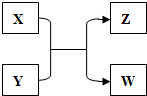 X、Y、Z、W四种物质有如下相互转化关系(其中X、W为单质,Y、Z为化合物,未列出反应条件).
X、Y、Z、W四种物质有如下相互转化关系(其中X、W为单质,Y、Z为化合物,未列出反应条件). .
.