题目内容
16.铝在空气中能够稳定存在的原因是( )| A. | 铝的活泼性差 | B. | 铝表面有致密的氧化膜 | ||
| C. | 铝与氧气不反应 | D. | 铝的还原性差 |
分析 铝在空气中与氧气反应,其表面生成一层致密的氧化物薄膜,从而阻止了铝进一步氧化,使铝在空气中能够稳定存在.
解答 解:A、铝是一种比较活泼的金属,故A错误;
B、铝在空气中与氧气反应,其表面生成一层致密的氧化物薄膜,这是铝在空气中能够稳定存在的原因,故B正确;
C、常温下,铝在空气中与氧气反应生成氧化铝,故C错误;
D、铝的还原性比较强,故D错误.
故选B.
点评 本题主要考查了铝的化学性质,只有准确理解、全面掌握铝的化学性质才能完成有关的练习题.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.仪器名称为“容量瓶”的是( )
| A. |  | B. |  | C. |  | D. |  |
9.水热法制备Fe3O4纳米颗粒的反应为3Fe2++2S2O32-+O2+xOH-═Fe3O4+S4O62-+2H2O.下列说法中正确的是( )
| A. | x=2 | |
| B. | 参加反应的Fe2+全部作还原剂 | |
| C. | 每生成1molFe3O4,反应转移电子的总物质的量为4mol电子 | |
| D. | 1molFe2+被氧化时,被Fe2+还原的O2的物质的量为$\frac{1}{3}$mol |
4.将pH为9的NaOH溶液与pH为11的NaOH溶液等体积混合后,所得的溶液中氢离子浓度最接近于( )
| A. | $\frac{1}{2}$(10-9+10-11) mol•L-1 | B. | 2×10-11mol•L-1 | ||
| C. | (1×10-14-5×10-4) mol•L-1 | D. | (10-9+10-11) mol•L-1 |
11.由两种金属组成的混合物4.8g,跟氯气完全反应时,消耗氯气2.24L(标准状况),则混合物的组成可能是( )
| A. | 镁和铁 | B. | 钠和铁 | C. | 钠和铝 | D. | 铁和铜 |
1.现有三组溶液:①汽油和氯化钠溶液 ②碘的CCl4溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
| A. | 萃取、蒸发、分液 | B. | 分液、蒸馏、萃取 | C. | 分液、萃取、蒸馏 | D. | 蒸馏、萃取、分液 |
8.已知反应:
①Cl2+2KBr═2KCl+Br2,
②KClO3+6HCl(浓)═3Cl2+KCl+3H2O,
③Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,下列说法正确的是( )
①Cl2+2KBr═2KCl+Br2,
②KClO3+6HCl(浓)═3Cl2+KCl+3H2O,
③Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,下列说法正确的是( )
| A. | 反应①中的氧化剂Cl2,氧化产物是KCl | |
| B. | 氧化性由强到弱顺序为 Cl2>KClO3>Br2 | |
| C. | 反应③中的HNO3体现了酸性和氧化性 | |
| D. | 反应③中有0.4mol HNO3参加反应时,转移电子物质的量为0.4mol |
5.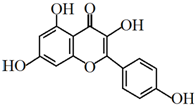 山萘酚(Kaempf erol)结构如图所示,且大量存在于水果、蔬菜、豆类、茶叶中,具有多种生物学作用,如抗氧化、抑制肿瘤生长及保护肝细胞等作用.下列有关山萘酚的叙述正确的是( )
山萘酚(Kaempf erol)结构如图所示,且大量存在于水果、蔬菜、豆类、茶叶中,具有多种生物学作用,如抗氧化、抑制肿瘤生长及保护肝细胞等作用.下列有关山萘酚的叙述正确的是( )
 山萘酚(Kaempf erol)结构如图所示,且大量存在于水果、蔬菜、豆类、茶叶中,具有多种生物学作用,如抗氧化、抑制肿瘤生长及保护肝细胞等作用.下列有关山萘酚的叙述正确的是( )
山萘酚(Kaempf erol)结构如图所示,且大量存在于水果、蔬菜、豆类、茶叶中,具有多种生物学作用,如抗氧化、抑制肿瘤生长及保护肝细胞等作用.下列有关山萘酚的叙述正确的是( )| A. | 结构式中含有羟基、醚键、酯基、碳碳双键 | |
| B. | 可发生取代反应、水解反应、加成反应 | |
| C. | 可与NaOH反应,不能与NaHCO3反应 | |
| D. | 1 mol山萘酚与溴水反应最多可消耗4 mol Br2 |
6.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 在常温常压下,2.24L SO2与O2混合气体中所含氧原子数为0.2NA | |
| B. | 标准状况下,20g D2O分子中所含中子数为10NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 50mL 12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |