题目内容
4.近年来,某些轻金属元素的含氢化合物及其复合体系作为氢源受到广泛关注.化合物甲(LiXH2)和乙(LiH)都是具有潜在应用价值的释氢材料.将4.60g甲在一定条件下加热至完全分解,可生成固体化合物A,并释放出2.24L气体B(已折算成标准状况),B可使湿润的红色石蕊试纸变蓝.请推测并回答:
(1)甲的化学式LiNH2.
(2)甲加热分解生成A和B的化学方程式2 LiNH2$\frac{\underline{\;加热\;}}{\;}$Li2NH+NH3↑.
(3)乙与水发生反应的化学方程式LiH+H2O=LiOH+H2↑.
(4)丙是由X和Li组成的二元化合物,其阴离子的电子数和二氧化碳相同,丙分解可生成另一种形式的二元化合物和一种无色无味的单质气体.写出丙发生分解反应的化学方程式3LiN3=Li3N+4N2↑.
(5)某同学认为:乙能与B发生氧化还原反应生成甲.请判断该同学的说法是否合理,并说明理由该同学说法合理.LiH中氢元素为-1价,NH3氢元素为+1价,根据氧化还原归中原理,能发生反应生成甲.
分析 (1)(2)化合物甲(LiXH2)加热至完全分解,可生成固体化合物A,并释放出2.24L气体B,B可使湿润的红色石蕊试纸变蓝,则B为NH3,由元素守恒可知,X为N元素,甲为LiNH2,4.60g甲的物质的量为$\frac{4.60g}{23g/mol}$=0.2mol,氨气物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,根据原子守恒可知A中Li、N、H原子数目之比为0.2mol:(0.2mol-0.1mol):(0.4mol-0.3mol)=2:1:1,故A的化学式为Li2NH;
(3)LiH与水反应生成LiOH与氢气;
(4)丙是由X(氮)和Li组成的二元化合物,其阴离子的电子数和二氧化碳相同,则丙为LiN3,丙分解可生成另一种形式的二元化合物和一种无色无味的单质气体,分解生成Li3N、N2;
(5)LiH中氢元素为-1价,NH3氢元素为+1价,根据氧化还原归中原理,能发生反应生成甲.
解答 解:(1)化合物甲(LiXH2)加热至完全分解,可生成固体化合物A,并释放出2.24L气体B,B可使湿润的红色石蕊试纸变蓝,则B为NH3,由元素守恒可知,X为N元素,甲为LiNH2,故答案为:LiNH2;
(2)4.60g甲的物质的量为$\frac{4.60g}{23g/mol}$=0.2mol,氨气物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,根据原子守恒可知A中Li、N、H原子数目之比为0.2mol:(0.2mol-0.1mol):(0.4mol-0.3mol)=2:1:1,故A的化学式为Li2NH,甲加热分解生成A和B的化学方程式:2 LiNH2$\frac{\underline{\;加热\;}}{\;}$Li2NH+NH3↑,
故答案为:2 LiNH2$\frac{\underline{\;加热\;}}{\;}$Li2NH+NH3↑;
(3)LiH与水反应生成LiOH与氢气,反应方程式为:LiH+H2O=LiOH+H2↑,
故答案为:LiH+H2O=LiOH+H2↑;
(4)丙是由X(氮)和Li组成的二元化合物,其阴离子的电子数和二氧化碳相同,则丙为LiN3,丙分解可生成另一种形式的二元化合物和一种无色无味的单质气体,分解生成Li3N、N2,丙发生分解反应的化学方程式:3LiN3=Li3N+4N2↑,
故答案为:3LiN3=Li3N+4N2↑;
(5)LiH中氢元素为-1价,NH3氢元素为+1价,根据氧化还原归中原理,能发生反应生成甲,该同学说法合理,
故答案为:该同学说法合理.LiH中氢元素为-1价,NH3氢元素为+1价,根据氧化还原归中原理,能发生反应生成甲.
点评 本题考查无机物推断,题目素材不是中学内容,侧重考查学生分析推理与计算能力,较好的考查学生对知识迁移应用,难度中等.

| A. | HCl的电子式: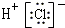 | B. | ${\;}_{8}^{18}$O2-离子的原子结构示意图: | ||
| C. | CO2分子的结构式:O=C=O | D. | 四氯化碳分子比例模型: |
| A. | 第二期ⅣA族 | B. | 第三期ⅥA族 | C. | 第二期ⅥA族 | D. | 第三期ⅣA族 |
| A. | 液溴易挥发,实验室常用水液封并密封保存 | |
| B. | 金属钠遇到氧气立即反应,常保存在煤油中 | |
| C. | 浓硫酸有强腐蚀性,常温时不可用铁质容器贮运 | |
| D. | 硅酸钠溶液应用带橡胶塞的细口瓶保存 |
 中国药学家屠呦呦因青蒿素而获得2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列说法不正确的是( )
中国药学家屠呦呦因青蒿素而获得2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列说法不正确的是( )| A. | 该物质易溶于冷水 | B. | 能够发生水解反应 | ||
| C. | 每个分子中含有3个六元环 | D. | 青蒿素具有强氧化性 |
| A. | x=2 | |
| B. | 参加反应的Fe2+全部作还原剂 | |
| C. | 每生成1molFe3O4,反应转移电子的总物质的量为4mol电子 | |
| D. | 1molFe2+被氧化时,被Fe2+还原的O2的物质的量为$\frac{1}{3}$mol |
| A. | 镁和铁 | B. | 钠和铁 | C. | 钠和铝 | D. | 铁和铜 |
| A. | Mg2+、SO42-、K+、Cl- | B. | Na+、NH4+、NO3-、Fe3+ | ||
| C. | K+、CO32-、Cl-、Br- | D. | Ba2+、Na+、OH-、SO42- |