题目内容
实验:
①向2mL 1mol?L-1 NaBr溶液中通入少量氯气,溶液变为黄色;
②取①所得溶液滴加到淀粉KI试纸上,试纸变蓝;
③向①所得溶液继续通入氯气,溶液由黄色变成橙色.
下列分析不正确的是( )
①向2mL 1mol?L-1 NaBr溶液中通入少量氯气,溶液变为黄色;
②取①所得溶液滴加到淀粉KI试纸上,试纸变蓝;
③向①所得溶液继续通入氯气,溶液由黄色变成橙色.
下列分析不正确的是( )
| A、仅根据实验①能说明还原性:Br->Cl- |
| B、仅根据实验②能说明氧化性:Br2>I2 |
| C、上述实验验证了Cl2、Br2、I2的氧化性相对强弱 |
| D、向实验③所得溶液中加CCl4,充分振荡,下层为橙红色 |
考点:卤素原子结构及其性质的比较
专题:卤族元素
分析:A.还原性:还原剂>还原产物;
B.①所得溶液可能含有氯气;
C.根据③指知①中氯气不足;
D.CCl4密度比水大.
B.①所得溶液可能含有氯气;
C.根据③指知①中氯气不足;
D.CCl4密度比水大.
解答:
解:A.Cl2+2NaBr=Br2+2NaCl,说明还原性:Br->Cl-,故A正确;
B.①所得溶液可能含有氯气,氯气能氧化碘离子得到I2,不能说明氧化性:Br2>I2,故B错误;
C.根据③指知①中氯气不足,与碘离子反应的是溴单质,能说明氧化性:Br2>I2,结合Cl2+2NaBr=Br2+2NaCl可以得出:Cl2>Br2>I2,故C正确;
D.CCl4密度比水大,下层为橙红色是被氧化出来的溴单质溶于CCl4,故D正确.
故选B.
B.①所得溶液可能含有氯气,氯气能氧化碘离子得到I2,不能说明氧化性:Br2>I2,故B错误;
C.根据③指知①中氯气不足,与碘离子反应的是溴单质,能说明氧化性:Br2>I2,结合Cl2+2NaBr=Br2+2NaCl可以得出:Cl2>Br2>I2,故C正确;
D.CCl4密度比水大,下层为橙红色是被氧化出来的溴单质溶于CCl4,故D正确.
故选B.
点评:本题考查化学实验方案的设计,涉及物质性质的考查,侧重点较为基础,题目难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列溶液中氯离子的浓度与1L 1mol/L的AlCl3溶液中氯离子物质的量浓度相等的是( )
| A、1L 1mol/L的NaCl溶液 |
| B、1.5L 2mol/LNH4Cl溶液 |
| C、1L 1mol/L的AlCl3溶液和1mol/L的FeCl2混合溶液 |
| D、2L 1.5mol/L的CaCl2溶液 |
分子式C4H8O2的有机物与硫酸溶液共热可得有机物A和B.将A氧化最终可得C,且B和C为同系物.若B可发生斐林反应,则原有机物的结构简式为( )
| A、HCOOCH2CH2CH3 |
| B、CH3COOCH2CH3 |
| C、CH3CH2COOCH3 |
| D、HOCH2CH2CH2CHO |
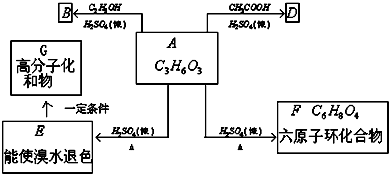
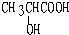 ).在浓硫酸存在下,A可发生如图所示的反应.
).在浓硫酸存在下,A可发生如图所示的反应.