题目内容
(1)①现有11g由
H和
O组成的水分子的物质的量 mol,其中含中子数为 mol,电子数为 个.
②请画出
O2-微粒的结构示意图: .
(2)质量相等的两种物质SO2和SO3,两种物质中硫元素质量之比为 ,分子物质的量之比为 ,所含氧原子个数之比为 .
(3)0.2L 0.5mol/L Al2(SO4)3溶液和0.5L 0.5mol/L Al2(SO4)3溶液所含SO42-离子浓度之比为 ,SO42-离子数目之比为 .
(4)20.6g NaR 含有Na+0.2mol,则NaR的摩尔质量为 ,则含R 8.0g 的NaR的物质的量为 mol.
2 1 |
18 8 |
②请画出
18 8 |
(2)质量相等的两种物质SO2和SO3,两种物质中硫元素质量之比为
(3)0.2L 0.5mol/L Al2(SO4)3溶液和0.5L 0.5mol/L Al2(SO4)3溶液所含SO42-离子浓度之比为
(4)20.6g NaR 含有Na+0.2mol,则NaR的摩尔质量为
考点:物质的量的相关计算
专题:
分析:(1)①根据n=
计算水的物质的量,结合分子含有含有中子数、电子数计算中子、电子的物质的量,再根据N=nNA计算电子数目;
②O2-离子质子数为8,核外电子数为10,有2个电子层,各层电子数为2、8;
(2)令SO2和SO3的质量都为1g,根据n=
计算它们的物质的量,根据m=nM计算硫元素质量之比,分子数目之比等于物质的量之比,结合分子中含有O原子数目确定所含氧原子个数之比;
(3)溶液中c(SO42-)=3c[Al2(SO4)3],据此判断SO42-离子浓度之比;根据n=cV确定SO42-离子数目之比.
(4)根据M=
计算NaR的摩尔质量;进而计算R的摩尔质量,根据n=
计算n(R),结合化学式确定n(NaR).
| m |
| M |
②O2-离子质子数为8,核外电子数为10,有2个电子层,各层电子数为2、8;
(2)令SO2和SO3的质量都为1g,根据n=
| m |
| M |
(3)溶液中c(SO42-)=3c[Al2(SO4)3],据此判断SO42-离子浓度之比;根据n=cV确定SO42-离子数目之比.
(4)根据M=
| m |
| n |
| m |
| M |
解答:
解:(1)①由
H和
O组成的水分子的相对分子质量为22,则11g的物质的量为
=0.5mol,其中含中子数为(2×1+18-8)×0.5mol=6mol,
电子数为0.5mol×10×NA/mol=5NA,
故答案为:0.5;6;5NA;
②
O2-微粒核外有2个电子层,最外层电子数为8,结构示意图为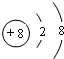 ,故答案为:
,故答案为: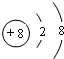 ;
;
(2)令SO2和SO3的质量都为1g,SO2的物质的量=
=
mol,SO3的物质的量=
=
mol,
二者含有硫元素质量之比=
mol×32g/mol:
mol×32g/mol=5:4
分子数目之比等于物质的量之比=
mol:
mol=5:4
所含氧原子个数之比═
mol×2:
mol×3=5:6
故答案为:5:4;5:4;5:6;
(3)两Al2(SO4)3溶液的浓度相等,溶液中c(SO42-)=3c[Al2(SO4)3],故两溶液中SO42-离子浓度相等,所含SO42-离子浓度之比=1:1;
SO42-离子浓度相等,根据n=cV可知,SO42-离子数目之比=物质的量之比=体积之比=0.2L:0.5L=2:5,
故答案为:1:1;2:5;
(4)20.6g NaR含有Na+0.2mol,NaR的物质的量为0.2mol,NaR的摩尔质量为
=103g/mol,故R的摩尔质量=103g/mol-23g/mol=80g/mol,8gR元素物质的量=
=0.1mol,故含R 8.0g的NaR的物质的量为0.1mol,
故答案为:103g/mol;0.1.
2 1 |
18 8 |
| 11g |
| 22g/mol |
电子数为0.5mol×10×NA/mol=5NA,
故答案为:0.5;6;5NA;
②
18 8 |
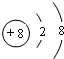 ,故答案为:
,故答案为: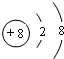 ;
;(2)令SO2和SO3的质量都为1g,SO2的物质的量=
| 1g |
| 64g/mol |
| 1 |
| 64 |
| 1g |
| 80g/mol |
| 1 |
| 80 |
二者含有硫元素质量之比=
| 1 |
| 64 |
| 1 |
| 80 |
分子数目之比等于物质的量之比=
| 1 |
| 64 |
| 1 |
| 80 |
所含氧原子个数之比═
| 1 |
| 64 |
| 1 |
| 80 |
故答案为:5:4;5:4;5:6;
(3)两Al2(SO4)3溶液的浓度相等,溶液中c(SO42-)=3c[Al2(SO4)3],故两溶液中SO42-离子浓度相等,所含SO42-离子浓度之比=1:1;
SO42-离子浓度相等,根据n=cV可知,SO42-离子数目之比=物质的量之比=体积之比=0.2L:0.5L=2:5,
故答案为:1:1;2:5;
(4)20.6g NaR含有Na+0.2mol,NaR的物质的量为0.2mol,NaR的摩尔质量为
| 20.6g |
| 0.2mol |
| 8g |
| 80g/mol |
故答案为:103g/mol;0.1.
点评:本题考查常用化学计量计算、方程式有关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目
下列比较不正确的是( )
| A、等浓度的NH4HSO4、NH3?H2O、(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的五种溶液,其中(NH4)2Fe(SO4)2溶液中c(NH4+)最大 |
| B、NaClO和BaCl2混合溶液:c(Na+)+2c(Ba2+)=c(ClO-)+c(HClO)+c(Cl-) |
| C、25℃下,0.2 mol?L-1 HCl溶液与0.2 mol?L-1 YOH(一元弱碱)溶液等体积混合(忽略混合后溶液体积的变化),则c(Cl-)=c(Y+)+c(YOH)=0.2 mol?L-1 |
| D、常温下,将0.2 mol?L-1某一元碱ROH溶液和0.1 mol?L-1HCl溶液等体积混合,混合后溶液pH<7,则c(ROH)>c(R+) |
下列电池工作时,O2在正极放电的是( )
 |  |  |  |
| A.锌锰电池 | B.氨燃料电池 | C.铅蓄电池 | D.镍镉电池 |
| A、A | B、B | C、C | D、D |
下列微粒属于等电子体的是( )
| A、N2 与O2 |
| B、CO与N2 |
| C、NO2 与O3 |
| D、HCl和H2S |
日常生活中,下列做法中不会对人体健康造成危害的是( )
| A、腌制腊类物质添加大量亚硝酸钠 |
| B、金针菇可用福尔马林浸泡来达到保鲜的目的 |
| C、用NaHCO3发酵面包 |
| D、竹笋用二氧化硫气体漂白 |
对于淀粉和纤维素[(C6H10O5)n]的叙述,正确的是( )
| A、互为同分异构体 |
| B、都是天然有机高分子化合物 |
| C、遇碘(I2)均会呈蓝色 |
| D、在人体内均会发生水解反应 |
下列分子,各原子均处于同一平面上的是( )
| A、NH3 |
| B、CCl4 |
| C、C2H4 |
| D、PCl3 |