题目内容
菠菜中含有一定量的草酸(HOOC-COOH)及草酸亚铁,现通过实验探究草酸和草酸亚铁的性质.
Ⅰ.探究草酸的性质
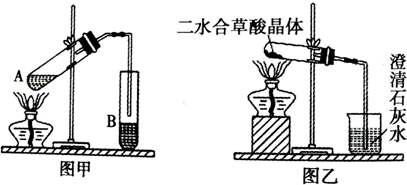
(1)向图甲装置的A试管加入3mL乙醇,然后边震荡试管边加入2mL浓硫酸和2mL草酸,按图甲链接好装置,加热3~5分钟,在B试管中有油状液体产生.该现象说明了反应(填有机反应类型) .导管口在B试管液面上侧附近的原因 .
(2)已知草酸分解的化学方程式为H2C2O4
H2O+CO2↑+CO↑.
通常情况下草酸是以二水合草酸晶体(熔点:101.5℃)的形式存在,现用乙装置加热二水合草酸晶体,验证草酸的受热分解产物,但有同学认为该装置不合理.请你根据题给的某些物理常数和试验目的,指出不合理的原因 、 ; (回答两条即可)
Ⅱ.探究草酸亚铁的热分解规律
将1.000克固体FeC2O4?2H2O放在一个可称量的容器中加热灼烧,固体质量随温度升高而变化,测得数据如下表:
(1)写出25~300℃时,固体发生变化的化学方程式 .
(2)500℃时,产物中氧元素的质量分数为 .
(3)写出600~900℃时,发生变化的化学方程式 .
Ⅰ.探究草酸的性质

(1)向图甲装置的A试管加入3mL乙醇,然后边震荡试管边加入2mL浓硫酸和2mL草酸,按图甲链接好装置,加热3~5分钟,在B试管中有油状液体产生.该现象说明了反应(填有机反应类型)
(2)已知草酸分解的化学方程式为H2C2O4
| 175℃ |
通常情况下草酸是以二水合草酸晶体(熔点:101.5℃)的形式存在,现用乙装置加热二水合草酸晶体,验证草酸的受热分解产物,但有同学认为该装置不合理.请你根据题给的某些物理常数和试验目的,指出不合理的原因
Ⅱ.探究草酸亚铁的热分解规律
将1.000克固体FeC2O4?2H2O放在一个可称量的容器中加热灼烧,固体质量随温度升高而变化,测得数据如下表:
| 温度/℃ | 25 | 300 | 350 | 400 | 500 | 600 | 900 |
| 固体质量/g | 1.000 | 0.800 | 0.800 | 0.400 | 0.444 | 0.444 | 0.429 |
(2)500℃时,产物中氧元素的质量分数为
(3)写出600~900℃时,发生变化的化学方程式
考点:性质实验方案的设计
专题:实验设计题
分析:Ⅰ(1)草酸含羧基,类比乙醇和乙酸发生酯化反应,可知草酸和乙醇发生了酯化反应;不宜伸入试管B的溶液中是防止加热不充分发生倒吸;
(2)二水合草酸晶体熔点低易液化,导管口方向不对;实验目的是检验所有分解产物,根据装置只能检查二氧化碳,草酸易挥发,没有除去草酸装置;
ⅡFeC2O4﹒2H2O带有结晶水,在25~300℃失去的可能是全部结晶水,也有可能是部分结晶水,若结晶水全部失去,则:FeC2O4.2H2O(s)
FeC2O4(s)+2H2O(g),固体减少的质量等于其所含结晶水的质量,通过计算验证;
350~400℃,FeC2O4进一步分解,质量减少一半,比较FeC2O4与铁的氧化物的相对分子质量,只有FeO符合要求,可得出在350~400℃时发生反应化学方程式:在400~500℃,FeO在灼烧过程中质量增加,可能是与空气中的氧气反应生成高价的氧化物.600~900℃的过程中固体质量又减少,由此推测固体物质可能发生如下变化:6FeO~3Fe2O3(结合氧原子)~2Fe3O4(再失去氧原子),对表中的数据进行验证.
(2)二水合草酸晶体熔点低易液化,导管口方向不对;实验目的是检验所有分解产物,根据装置只能检查二氧化碳,草酸易挥发,没有除去草酸装置;
ⅡFeC2O4﹒2H2O带有结晶水,在25~300℃失去的可能是全部结晶水,也有可能是部分结晶水,若结晶水全部失去,则:FeC2O4.2H2O(s)
| ||
350~400℃,FeC2O4进一步分解,质量减少一半,比较FeC2O4与铁的氧化物的相对分子质量,只有FeO符合要求,可得出在350~400℃时发生反应化学方程式:在400~500℃,FeO在灼烧过程中质量增加,可能是与空气中的氧气反应生成高价的氧化物.600~900℃的过程中固体质量又减少,由此推测固体物质可能发生如下变化:6FeO~3Fe2O3(结合氧原子)~2Fe3O4(再失去氧原子),对表中的数据进行验证.
解答:
解:Ⅰ(1)草酸含羧基,类比乙醇和乙酸发生酯化反应,可知草酸和乙醇发生了酯化反应;不宜伸入试管乙的溶液中是为了防止加热不充分发生倒吸,
故答案为:酯化反应(或取代反应);防止加热不充分而倒吸;
(2)二水合草酸晶体熔点低易液化,导管口方向不对;实验目的是检验所有分解产物,根据装置只能检查二氧化碳,草酸易挥发,没有除去草酸装置;
故答案为:二水合草酸晶体的熔点低,未分解之前就已经熔化并向试管口流动,不能完成分解实验;该装置只能检验一种分解产物(CO2),不能检验是否有其他分解产物;在未洗气的情况下将产物通入澄清的石灰水,还可能因草酸蒸汽与石灰水反应生成了草酸钙沉淀而对实验有干扰.(任答两条即可)
II.(1)FeC2O4﹒2H2O带有结晶水,在25~300℃失去的可能是全部结晶水,也有可能是部分结晶水,若结晶水全部失去,则:FeC2O4.2H2O(s)
FeC2O4(s)+2H2O(g)
180 36
1.000g m
m=
=0.2g,
固体减少的质量等于其所含结晶水的质量,因此推测正确;
故答案为:FeC2O4.2H2O
FeC2O4+2H2O;
(2)350~400℃,FeC2O4进一步分解,质量减少一半,比较FeC2O4与铁的氧化物的相对分子质量,只有FeO符合要求,可得出在350~400℃时发生反应化学方程式:FeC2O4
FeO+CO↑+CO2↑;
在400~500℃,FeO在灼烧过程中质量增加,可能是与空气中的氧气反应生成高价的氧化物.600~900℃的过程中固体质量又减少,由此推测固体物质可能发生如下变化:6FeO~3Fe2O3(结合氧原子)~2Fe3O4(再失去氧原子),对表中的数据进行验证:
2FeO~Fe2O3 △m(增加)
144 16
0.400g
≈0.044g=0.444g-0.400g
3Fe2O3~2Fe3O4△m(减少)
480 16
0.444g
≈0.015g=(0.444-0.429)g
符合要求.因此500℃时的产物为Fe2O3,氧元素的质量分数为30%,600~900℃时发生变化的化学方程式为
6Fe2O3
4Fe3O4+O2↑;
故答案为:30%;
(3)600~900℃时发生变化的化学方程式为6Fe2O3
4Fe3O4+O2↑;
故答案为:6Fe2O3
4Fe3O4+O2↑.
故答案为:酯化反应(或取代反应);防止加热不充分而倒吸;
(2)二水合草酸晶体熔点低易液化,导管口方向不对;实验目的是检验所有分解产物,根据装置只能检查二氧化碳,草酸易挥发,没有除去草酸装置;
故答案为:二水合草酸晶体的熔点低,未分解之前就已经熔化并向试管口流动,不能完成分解实验;该装置只能检验一种分解产物(CO2),不能检验是否有其他分解产物;在未洗气的情况下将产物通入澄清的石灰水,还可能因草酸蒸汽与石灰水反应生成了草酸钙沉淀而对实验有干扰.(任答两条即可)
II.(1)FeC2O4﹒2H2O带有结晶水,在25~300℃失去的可能是全部结晶水,也有可能是部分结晶水,若结晶水全部失去,则:FeC2O4.2H2O(s)
| ||
180 36
1.000g m
m=
| 1.000g×36 |
| 180 |
固体减少的质量等于其所含结晶水的质量,因此推测正确;
故答案为:FeC2O4.2H2O
| ||
(2)350~400℃,FeC2O4进一步分解,质量减少一半,比较FeC2O4与铁的氧化物的相对分子质量,只有FeO符合要求,可得出在350~400℃时发生反应化学方程式:FeC2O4
| ||
在400~500℃,FeO在灼烧过程中质量增加,可能是与空气中的氧气反应生成高价的氧化物.600~900℃的过程中固体质量又减少,由此推测固体物质可能发生如下变化:6FeO~3Fe2O3(结合氧原子)~2Fe3O4(再失去氧原子),对表中的数据进行验证:
2FeO~Fe2O3 △m(增加)
144 16
0.400g
| 16×0.400g |
| 144 |
3Fe2O3~2Fe3O4△m(减少)
480 16
0.444g
| 16×0.444g |
| 480 |
符合要求.因此500℃时的产物为Fe2O3,氧元素的质量分数为30%,600~900℃时发生变化的化学方程式为
6Fe2O3
| ||
故答案为:30%;
(3)600~900℃时发生变化的化学方程式为6Fe2O3
| ||
故答案为:6Fe2O3
| ||
点评:本题考查物质性质探究实验,意在考查考生的基本实验能力及实验数据分析能力,难度较大,要进行合理假设结合数据进行验证,需要熟悉铁的氧化物之间的转化,否则假设就变得困难.

练习册系列答案
相关题目
下列各组离子能大量共存,且溶液为无色透明的是( )
| A、Al3+、AlO2-、NO3-、Cl- |
| B、CrO42-、H+、K+、NO3- |
| C、Ba2+、Na+、HCO3-、OH- |
| D、K+、SO42-、S2-、Na+ |
环境保护部门为了使城市生活垃圾得到合理利用,对生活垃圾分类投放,其中塑料袋、旧橡胶是属于( )
| A、无机物 | B、有机物 |
| C、盐类 | D、非金属单质 |