题目内容
1.完成下列化学反应方程式:(1)将少量氯水滴入FeBr2溶液中6FeBr2+3Cl2=2FeCl3+4FeBr3
(2)将过量稀硫酸加入到Na2S2O3溶液中Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O
(3)H2C2O4使酸性高锰酸钾溶液紫色褪去5H2C2O4+2KMnO4+3H2SO4═2MnSO4+K2SO4+8H2O+10CO2↑
(4)浓硝酸在加热时和铁的反应Fe+6HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+3NO2↑+3H2O
(5)二氧化氮和氧气溶入水中3NO2+H2O=2HNO3+NO
(6)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是akJ、bkJ、ckJ,则N2与H2反应生成NH3的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=(a+3b-6c)kJ/mol
(7)现将2mol SO2、1mol O2充入密闭容器中充分反应,放出热量为akJ,此时测得SO2的转化率为40%,写出该反应的热化学方程式2SO2(g)+O2(g)=2SO3(g)△H=-2.5akJ/mol.
分析 (1)亚铁离子的还原性较强,氯气不足时亚铁离子优先反应;
(2)酸性条件下硫代硫酸钠与氢离子反应生成二氧化硫和硫单质;
(3)酸性高锰酸钾溶液具有强氧化性,能够将草酸氧化成二氧化碳;
(4)铁与浓硝酸在加热条件下反应生成硝酸铁、二氧化氮气体和水;
(5)二氧化氮与水反应生成硝酸和NO;
(6)依据反应焓变=反应物键能总和-生成物键能总和计算焓变,标注物质狙击状态写出热化学方程式;
(7)发生反应为2SO2(g)+O2(g)=2SO3(g),根据二氧化硫的转化率计算出2mol二氧化硫完全反应放出热量,然后写出反应的化学方程式.
解答 解:(1)将少量氯水滴入FeBr2溶液中,只有亚铁离子被氧化,反应的化学方程式为:6FeBr2+3Cl2=2FeCl3+4FeBr3,
故答案为:6FeBr2+3Cl2=2FeCl3+4FeBr3;
(2)将过量稀硫酸加入到Na2S2O3溶液中,反应生成硫酸钠、二氧化硫气体、硫单质和水,反应的化学方程式为:Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O,
故答案为:Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O;
(3)H2C2O4使酸性高锰酸钾溶液,二者发生氧化还原反应导致溶液紫色褪去,反应的化学方程式为:5H2C2O4+2KMnO4+3H2SO4═2MnSO4+K2SO4+8H2O+10CO2↑,
故答案为:5H2C2O4+2KMnO4+3H2SO4═2MnSO4+K2SO4+8H2O+10CO2↑;
(4)浓硝酸在加热时和铁能够发生反应生成二氧化氮气体,反应的化学方程式为:Fe+6HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+3NO2↑+3H2O,
故答案为:Fe+6HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+3NO2↑+3H2O;
(5)二氧化氮和氧气溶入水中生成硝酸和一氧化氮气体,反应的化学方程式为:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
(6)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是akJ、bkJ、ckJ,则N2与H2反应生成NH3的反应焓变=(c+3a-6b)kJ/mol,该反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=(a+3b-6c)kJ/mol,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=(a+3b-6c)kJ/mol;
(7)2mol SO2、1mol O2充入密闭容器中充分反应,放出热量为akJ,此时测得SO2的转化率为40%,2mol二氧化硫完全反应放出热量为:$\frac{2mol}{2mol×40%}$×akJ=2.5akJ,该反应的热化学方程式为:2SO2(g)+O2(g)=2SO3(g)△H=-2.5akJ/mol,
故答案为:2SO2(g)+O2(g)=2SO3(g)△H=-2.5akJ/mol.
点评 本题考查较为综合,涉及化学方程式、热化学方程式的书写等知识,题目难度中等,明确发生反应实质为解答关键,注意掌握化学方程式、热化学方程式的书写原则,试题培养了学生的规范答题能力.

| A. | CH3Cl | B. |  | C. | CH3CH2OH | D. | CH2=CHCl |
| A. | Na、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | NH4+、K+、Cl-、OH- | D. | Fe3+、K+、SCN-、Cl- |
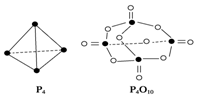 白磷与氧气可发生如下反应:P4+5O2═P4O10已知断裂下列化学键需要吸收的能量分别 为P-O:a kJ•mol-1、P-P:b kJ•mol-1、P═O:c kJ•mol-1 O═O:d kJ•mol-1.根据如图所示的分子结构和有关数据估算该反应的△H,其中正确的是( )
白磷与氧气可发生如下反应:P4+5O2═P4O10已知断裂下列化学键需要吸收的能量分别 为P-O:a kJ•mol-1、P-P:b kJ•mol-1、P═O:c kJ•mol-1 O═O:d kJ•mol-1.根据如图所示的分子结构和有关数据估算该反应的△H,其中正确的是( )| A. | (6b+5d-4c-12a) kJ•mol-1 | B. | (4b+5d-4c-12a) kJ•mol-1 | ||
| C. | (4c+12a-4b-5d) kJ•mol-1 | D. | (4c+12a-6b-5d) kJ•mol-1 |
| A. | 200g63%的浓硝酸中含氧原子个数为6NA | |
| B. | 50mL12mol•L-1 盐酸和足量MnO2共热,转移的电子数目为0.3NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标况下)气体时,电路中通过的电子数目为4NA | |
| D. | 若CH3COONa溶液中CH3COO-的数目为6NA,则Na+的目为6NA |
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.2NA | |
| B. | 2 L 0.5mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | 18g H2O含有10NA个质子 | |
| D. | 标准状况下,11.2L苯中含有分子的数目为0.5NA |
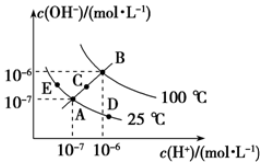 已知水的电离平衡曲线如图所示,
已知水的电离平衡曲线如图所示,