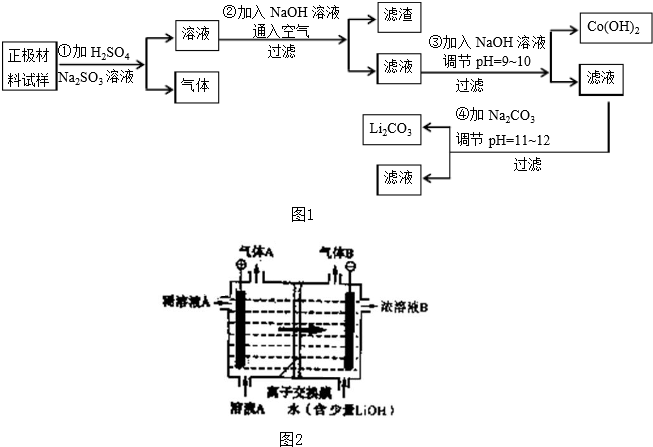
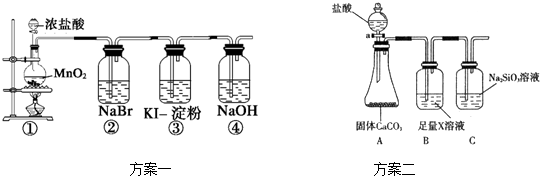
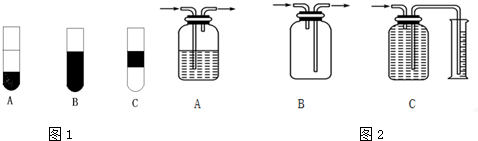
题目内容
把10.2g镁铝合金的粉末放入过量的盐酸中,得到11.2L H2(标准状况下).试计算:(原子量:Mg-24、Al-27)
(1)该合金中镁的质量分数.
(2)该合金中镁与铝的物质的量之比.
(3)该合金溶于足量的烧碱溶液中,产生H2的体积(标准状况下)是多少?
(1)该合金中镁的质量分数.
(2)该合金中镁与铝的物质的量之比.
(3)该合金溶于足量的烧碱溶液中,产生H2的体积(标准状况下)是多少?
考点:有关混合物反应的计算,镁、铝的重要化合物
专题:
分析:题中涉及反应有:Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,结合反应的方程式可列方程式组计算.
解答:
解:(1)n(H2)=
=0.5mol,
设10.2g合金中含有xmolMg,ymolAl,
由Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,
可得:24x+27y=10.2
x+1.5y=0.5
解得:x═0.2,y=0.2,
则m(Mg)=0.2mol×24g/mol=4.8g,
则Mg的质量分数为
×100%=47%,
答:该合金中铝的质量分数为47%;
(2)合金中Mg为0.2mol,Al为0.2mol,则合金中镁与铝的物质的量之比1:1;
答:合金中镁与铝的物质的量之比1:1;
(3)10.2g镁铝合金的粉末中含有0.2molAl,
将上述合金粉末放入过量的氢氧化钠溶液中,只有Al和碱反应,发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
由方程式可知0.2molAl参加反应可生成0.3mol氢气,则V=nVm=6.72L;
答:产生H2的体积(标准状况下)是6.72L.
| 11.2L |
| 22.4L/mol |
设10.2g合金中含有xmolMg,ymolAl,
由Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,
可得:24x+27y=10.2
x+1.5y=0.5
解得:x═0.2,y=0.2,
则m(Mg)=0.2mol×24g/mol=4.8g,
则Mg的质量分数为
| 4.8 |
| 10.2 |
答:该合金中铝的质量分数为47%;
(2)合金中Mg为0.2mol,Al为0.2mol,则合金中镁与铝的物质的量之比1:1;
答:合金中镁与铝的物质的量之比1:1;
(3)10.2g镁铝合金的粉末中含有0.2molAl,
将上述合金粉末放入过量的氢氧化钠溶液中,只有Al和碱反应,发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
由方程式可知0.2molAl参加反应可生成0.3mol氢气,则V=nVm=6.72L;
答:产生H2的体积(标准状况下)是6.72L.
点评:本题考查混合物的计算,题目难度不大,注意根据物质的性质书写反应的化学方程式,根据质量守恒可列式计算.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
把下列四种 X 溶液分别加入四个盛有 10mL2mol?L-1盐酸的烧杯中,均匀加水稀释到50mL.此时X 和盐酸进行反应.其中反应速率最大的是( )
| A、40mL 1.5 mol?L-1的 X 溶液 |
| B、20mL 2 mol?L-1的 X 溶液 |
| C、10mL 4 mol?L-1的 X 溶液 |
| D、l0mL 2 mol?L-1的 X 溶液 |