题目内容
20.按图示装置进行电解实验,随着实验进行下列数值变小的是( )
| A. | Cu2+物质的量浓度 | B. | Cl-物质的量浓度 | ||
| C. | Cu极质量 | D. | C(石墨)极质量 |
分析 图示为电解氯化铜溶液装置,石墨为阳极,氯离子在阳极放电生成氯气,石墨电极质量不变,Cu为阴极,铜离子在阴极放电生成Cu,Cu电极质量增加,据此分析.
解答 解:A.铜离子在阴极放电生成Cu,Cu2+物质的量浓度减小,故A正确;
B.氯离子在阳极放电生成氯气,Cl-物质的量浓度减小,故B正确;
C.a为阴极,铜离子在阴极放电生成Cu,Cu电极质量增加,故C错误;
D.石墨为阳极,氯离子在阳极放电生成氯气,石墨电极质量不变,故D错误.
故选AB.
点评 本题考查了电解池的电解原理,注意离子的放电顺序是解答本题的关键,电解氯化铜溶液是电解电解质型,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.以溴乙烷为原料制取1,2-二溴乙烷,下列转化方案中最好的是( )
| A. | CH3CH2Br$→_{△}^{HBr溶液}$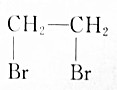 | |
| B. | CH3CH2Br$→_{光照}^{Br_{2}}$CH2BrCH2Br | |
| C. | CH3CH2Br$→_{△}^{NaOH醇溶液}$CH2═CH2$\stackrel{HBr}{→}$CH2BrCH3$→_{光照}^{Br_{2}}$CH2BrCH2Br | |
| D. | CH3CH2Br$→_{△}^{NaOH醇溶液}$CH2═CH2$\stackrel{溴水}{→}$CH2BrCH2Br |
11.下列有关电解质溶液的说法正确的是( )
| A. | 常温下,0.1 mol/L Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32-)>c(HCO3- )>c(OH-)>c(H+) | |
| C. | pH相同的 ①CH3COONa ②NaHCO3 ③NaClO三种溶液的c(Na+):①>②>③ | |
| D. | 向0.1 mol•L-1的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}.{H}_{2}O)}$增大 |
5.固体X只可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的一种或几种组成,某同学对该固体进行了如下实验,下列判断正确的是( )
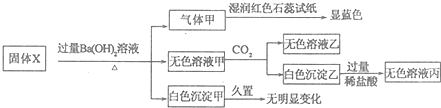

| A. | 白色沉淀乙不一定是Al(OH)3 | B. | 气体甲一定是纯净物 | ||
| C. | 固体X中一定存在(NH4)2SO4、MgCl2 | D. | 固体X中一定存在FeCl2、AlCl3 |
12.下列物质的沸点最高的是( )
| A. | 氯乙烷 | B. | 乙醇 | C. | 甲醛 | D. | 丁烷 |
9.欲除去甲烷气体中混有的乙烯得到纯净的甲烷,最好依次通过盛有( )试剂的装置.
| A. | 澄清石灰水、浓H2SO4 | B. | 酸性KMnO4溶液、浓H2SO4 | ||
| C. | 溴水、浓H2SO4 | D. | CCl4、碱石灰 |
 如图是电解CuCl2溶液的装置,其中c、d为石墨电极.
如图是电解CuCl2溶液的装置,其中c、d为石墨电极.
 (Ⅰ) W,X,Y,Z四种短周期元素,原子序数依次增大,在周期表中W与X相邻、Y与Z相邻; X,Y位于同一主族,它们能组成YX2,YX3两种常见化合物;W元素的氢化物与Z元素的氢化物反应生成盐.请回答下列问题:
(Ⅰ) W,X,Y,Z四种短周期元素,原子序数依次增大,在周期表中W与X相邻、Y与Z相邻; X,Y位于同一主族,它们能组成YX2,YX3两种常见化合物;W元素的氢化物与Z元素的氢化物反应生成盐.请回答下列问题: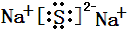 .(用元素符号表示)
.(用元素符号表示) .
.