题目内容
8. 如图是电解CuCl2溶液的装置,其中c、d为石墨电极.
如图是电解CuCl2溶液的装置,其中c、d为石墨电极.(1)正极为a(填“a”或“b”),
(2)阳极反应式为2Cl--2e-═Cl2↑,检验该阳极产物的方法是用湿润的淀粉碘化钾试纸放在该电极附近,试纸变蓝
(3)电解一段时间后发现阴极增重6.4g,则外电路中通过的电子的物质的量是0.2 mol.
分析 (1)电解CuCl2溶液的装置,其中c、d为石墨电极,依据电流流向可知,电源电极a为正极,与a连接的电极c为电解池的阳极;b为负极,与b电极相连的电极d为电解池的阴极;
(2)阳极是c电极,溶液中氯离子失电子生成氯气,依据氯气使湿润的淀粉碘化钾试纸放在c电极附近,若试纸变蓝,则证明产生的气体为氯气;
(3)依据电极反应计算反应过程中的电子转移数.
解答 解:(1)电解CuCl2溶液的装置,其中c、d为石墨电极,依据电流流向可知,电源电极a为正极,与a连接的电极c为电解池的阳极;b为负极,与b电极相连的电极d为电解池的阴极,
故答案为:a;c;
(2)阳极是c电极,溶液中氯离子在阳极失电子发生氧化反应,电极反应为:2Cl-一2e一=C12↑;生成的氯气用湿润的淀粉碘化钾试纸放在c电极附近,若试纸变蓝,则证明产生的气体为氯气;
故答案为:2Cl-一2e一=C12↑;用湿润的淀粉碘化钾试纸放在c电极附近,若试纸变蓝,则证明产生的气体为氯气;
(3)电解一段时间后发现阴极增重6.4g,依据离子放电顺序溶液中铜离子得到电子生成铜,物质的量=6.4÷64=0.1mol,电极反应为:Cu2++2e-=Cu,电子转移0.2mol,外电路中通过的电子的物质的量是0.2mol,
故答案为:0.2.
点评 本题考查了电解池原理的分析判断,依据电流流向分析判断电极名称,书写电极反应是关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.一定温度下的密度容器中发生:2HI(g)?I2(g)+H2(g),该反应达平衡状态的标志是( )
| A. | 气体的颜色不再发生变化 | |
| B. | 容器内的压强不再发生变化 | |
| C. | 单位时间内,每断裂2mol H-I键,同时有1mol I-I键生成 | |
| D. | 单位时间内,每断裂1mol H-H键,同时有1mol I-I键生成 |
16.Na2S2O3是一种重要的化学试剂,在酸性条件下S2O32-迅速分解为S和SO2,在医疗上运用其还原性和硫的杀菌作用治疗疾病.某小组用下图所示装置对Cl2与Na2S2O3的反应进行探究(气密性已检验).
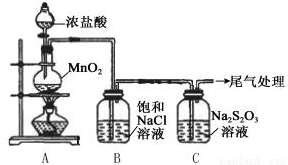
实验操作和现象:
(1)A中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B中饱和NaCl溶液的作用是除去Cl2中的HCl,防止对Cl2与Na2S2O3的反应产生干扰.
(3)C中生成黄色沉淀的离子方程式是S2O32-+2H+=S↓+SO2↑+H2O.
(4)将C中雾通入品红溶液检验是否有SO2,该操作不合理的理由是C中雾有氯气.
(5)C中滤液与氯化钡溶液反应生成白色沉淀,甲同学认为利用该现象可证明Na2S2O3被Cl2氧化,反应的离子方程式是.乙同学认为,C中滤液用硝酸酸化后滴加硝酸银溶液,若有白色沉淀,也能证明Na2S2O3被Cl2氧化,丙同学认为不能证明,理由是氯气与水反应也能生成Cl-,所以检验出溶液中有Cl-也不能证明是Cl2氧化了Na2S2O3.

实验操作和现象:
| 操作 | 现象 |
| 打开分液漏斗活塞,滴加一定量浓盐酸,加热 | i.A中有黄绿色气体生成,C中液面上方有白雾,溶液中开始出现少量浑浊; ii.一段时间后,C中产生大量黄色沉淀. |
| 用湿润的淀粉碘化钾试纸检验C中白雾 | 淀粉碘化钾试纸变蓝 |
| C中浊液过滤后,取少量滤液用盐酸酸化,滴加氯化钡溶液 | 有白色沉淀生成 |
(2)B中饱和NaCl溶液的作用是除去Cl2中的HCl,防止对Cl2与Na2S2O3的反应产生干扰.
(3)C中生成黄色沉淀的离子方程式是S2O32-+2H+=S↓+SO2↑+H2O.
(4)将C中雾通入品红溶液检验是否有SO2,该操作不合理的理由是C中雾有氯气.
(5)C中滤液与氯化钡溶液反应生成白色沉淀,甲同学认为利用该现象可证明Na2S2O3被Cl2氧化,反应的离子方程式是.乙同学认为,C中滤液用硝酸酸化后滴加硝酸银溶液,若有白色沉淀,也能证明Na2S2O3被Cl2氧化,丙同学认为不能证明,理由是氯气与水反应也能生成Cl-,所以检验出溶液中有Cl-也不能证明是Cl2氧化了Na2S2O3.
20.按图示装置进行电解实验,随着实验进行下列数值变小的是( )


| A. | Cu2+物质的量浓度 | B. | Cl-物质的量浓度 | ||
| C. | Cu极质量 | D. | C(石墨)极质量 |
17.下列转化中,碳原子间的连接形成未发生改变的是( )
| A. | 丙酮与HCN发生加成反应 | |
| B. | 1,3-丁二烯生成 聚1,3-丁二烯 | |
| C. | 乙二醇与重铬酸钾溶液共热被氧化为乙二酸(HOOC-COOH) | |
| D. | 乙苯与酸性高锰酸钾溶液反应 |
18.昆仑玉常用于制作奖牌等纪念品,其主要成分是由“透闪石”和“阳起石”组成的纤维状微晶结合体,其中透闪石的化学成分为Ca2Mg5Si8O22(OH)2.下列有关说法不正确的是( )
| A. | Ca2Mg5Si8O22(OH)2属于硅酸盐 | |
| B. | 昆仑玉是混合物,透闪石中Mg元素与Ca元素的质量比是3:2 | |
| C. | 透闪石的化学式写成氧化物的形式为:2CaO•5MgO•8SiO2•H2O | |
| D. | 透闪石是一种新型无机非金属材料,易溶于水 |
 .
.
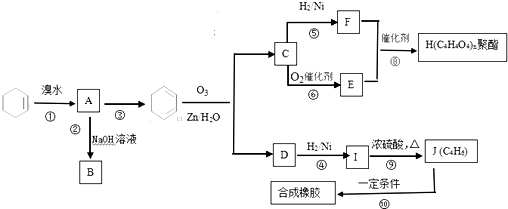
 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) .
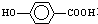
.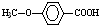 的同分异构体很多,其中符合下列条件有3种.
的同分异构体很多,其中符合下列条件有3种. .
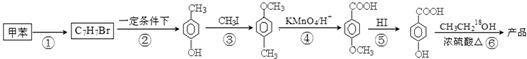
.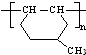 是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)注:合成路线的书写格式参照如下示例流程图:
是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)注:合成路线的书写格式参照如下示例流程图: .
.