题目内容
3.已知:0.1mol/LH2A溶液中c(H+)=0.11mol/L.(1)写出H2A的第一步电离方程式H2A=H++HA-.
(2)0.1mol/LNaHA溶液中离子浓度从大到小的顺序为c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),其中c(H+)>0.01mol/L(填“>”、“=”或“<”),
(3)写出H2A溶液与过量NaOH溶液反应的离子方程式H++HA-+2OH-=A2-+2H2O
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | HCN | 5×10-10 |
| H2CO3 | Ka1=4.2×10-7 | HClO | 3×10-8 |
| Ka2=5.6×10-11 |
②25℃时,0.01mol/LNaCN溶液的pH>7;
③在浓度均为0.01mol/L的CH3COONa、NaC10、Na2C03的混合溶液中,逐滴加人0.01mo l/LHCl,则体系中酸根离子反应的先后顺序为CO32-、ClO-、HCO3-、CH3COO-.
分析 (1)0.1mol/LH2A溶液中c(H+)=0.11mol/L,则H2A的第一步为完全电离;
(2)0.1mol/LNaHA溶液中HA-的电离程度大于水解程度,溶液显酸性;H2A溶液中第一步电离出来的氢离子抑制了第二步电离,则NaHA中HA-的电离程度大于H2A中HA-的电离程度;
(3)H2A溶液中主要存在H+和HA-;
(4)①电离常数越大,电解质的酸性越强;
②强碱弱酸盐水解显碱性;
③弱酸的酸性越弱,其酸根越易结合氢离子.
解答 解:(1)0.1mol/LH2A溶液中c(H+)=0.11mol/L,则H2A的第一步为完全电离,则H2A的第一步电离方程式:H2A=H++HA-;
故答案为:H2A=H++HA-;
(2)0.1mol/LNaHA溶液中HA-的电离程度大于水解程度,溶液显酸性,则溶液中离子浓度大小关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-);
0.1mol/LH2A溶液中c(H+)=0.11mol/L,NaHA中HA-的电离程度大于H2A中HA-的电离程度,所以NaHA中c(H+)>0.01mol/L;
故答案为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-);>;
(3)H2A溶液中主要存在H+和HA-,则H2A溶液与过量NaOH溶液反应的离子方程式:H++HA-+2OH-=A2-+2H2O;
故答案为:H++HA-+2OH-=A2-+2H2O;
(4)①电离常数越大,电解质的酸性越强,由表中数据可知,醋酸的酸性最强;故答案为:CH3COOH;
②强碱弱酸盐水解显碱性,NaCN属于强碱弱酸盐,所以25℃时0.01mol/LNaCN溶液的pH>7;故答案为:>;
③弱酸的酸性越弱,其酸根越易结合氢离子,又根据弱酸的电离平衡常数可知弱酸的酸性大小顺序为HCO3-<HClO<H2CO3<CH3COOH,所以体系中酸根离子反应的先后顺序为CO32-、ClO-、HCO3-、CH3COO-,
故答案为:CO32-、ClO-、HCO3-、CH3COO-.
点评 本题主要考查了弱电解质的电离、离子浓度大小比较、盐的水解原理的应用、电离常数的应用等,题目难度中等,注意根据电离平衡常数来判断酸性强弱,注意弱酸的酸性越弱,其酸根越易水解.

 名校课堂系列答案
名校课堂系列答案| 电化学应用 | 相关解释或说法 | |
| A | 以稀H2SO4为电解质的Cu-Zn原电池 | Cu为正极,正极上发生还原反应 |
| B | 电解CuCl2溶液 | 电子经过负极→阴极$\stackrel{通过电解液}{→}$阳极→正极 |
| C | 弱酸性环境下钢铁腐蚀 | 负极产生H2,正极处吸收O2 |
| D | 将铜闸门与外加电源负极相连 | 牺牲阳极的阴极保护法,可防止钢闸门腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
M(g)+N(g)?2P(g)△H1<0
X(g)+3Y(g)?2Z(g)△H2>0
进行相关操作且达到平衡后(忽略体积改变所做的功),下列说法中错误的是( )
| A. | 等压时,通入稀有气体He,反应容器中温度升高 | |
| B. | 等压时,通入Z气体,P气体的物质的量不变 | |
| C. | 等容时,通入稀有气体He,两个反应速率均不变 | |
| D. | 等容时,通入Z气体,Y的物质的量浓度增大 |
| A. | 洗涤了量取浓硫酸的量筒,并把洗涤液转移到容量瓶中 | |
| B. | 转移溶液前,容量瓶中含有少量蒸馏水 | |
| C. | 溶解硫酸用的烧杯、玻璃棒未洗涤 | |
| D. | 定容时俯视容量瓶的刻度线 |
| A. |  除去CO2中的HCl | B. |  干燥Cl2 | C. |  稀释浓硫酸 | D. |  分离乙醇和水 |
| A. | CH3Cl+Cl2$\stackrel{光}{→}$CH2Cl2+HCl 取代反应 | |
| B. | H2C=CH2+Br2→CH3CHBr2 加聚反应 | |
| C. | 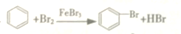 加成反应 加成反应 | |
| D. | 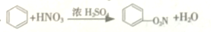 氧化反应 氧化反应 |
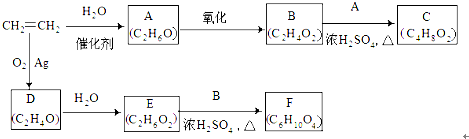
 E
E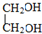 F
F 写出C酸性条件下水解的方程式CH3COOCH2CH3+H2O$?_{△}^{稀H_{2}SO_{4}}$CH3COOH+CH3CH2OH
写出C酸性条件下水解的方程式CH3COOCH2CH3+H2O$?_{△}^{稀H_{2}SO_{4}}$CH3COOH+CH3CH2OH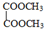 .
.

 .
. .
. (写出其中一种结构简式)
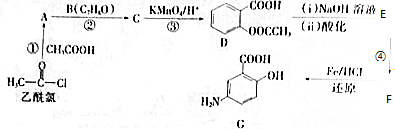
(写出其中一种结构简式)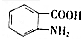 的流程图(无机试剂任选).合成路线流程图如下:
的流程图(无机试剂任选).合成路线流程图如下: