题目内容
2.下列说法正确的是( )| A. | 由0.1 mol/L一元碱BOH溶液的pH=10,可推知溶液存在BOH=B++OH- | |
| B. | 醋酸溶于水并达到电离平衡后,加水稀释,则溶液中的c(OH-)减小 | |
| C. | pH=3的醋酸加水稀释后,CH3COOH电离程度增大,醋酸电离常数不变 | |
| D. | 醋酸在醋酸钠溶液中的电离程度大于纯水中的电离程度 |
分析 A、0.1 mol/l一元碱BOH溶液的pH=10,说明BOH是弱碱;
B、加水稀释醋酸中氢离子浓度减小;
C、加水稀释促进醋酸的电离,电离常数只与温度有关;
D、醋酸根离子抑制醋酸的电离.
解答 解:A、0.1 mol/l一元碱BOH溶液的pH=10,说明BOH是弱碱,BOH溶液存在BOH?B++OH-,故A错误;
B、加水稀释醋酸,溶液中氢离子浓度减小,由于c(H+)×c(OH-)不变,所以c(OH-)增大,故B错误;
C、pH=3的醋酸加水稀释后,促进醋酸的电离,CH3COOH电离程度增大,电离常数只与温度有关,醋酸电离常数不变,故C正确;
D、醋酸根离子抑制醋酸的电离,所以醋酸在醋酸钠溶液中的电离程度小于纯水中的电离程度,故D错误.
故选C.
点评 本题考查弱电解质的电离,明确弱电解质电离特点是解本题关键,注意把握电离常数的影响因素,侧重于考查学生的分析能力,题目难度不大.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
4.下列有机物与足量溴水反应,有机物和溴的物质的量之比为1:2的是( )
| A. | 2-甲基-2-丁烯 | B. | 2-丁炔 | ||
| C. | 2-甲基-1,3-丁二烯 | D. | 1,3-丁二炔 |
17.下列说法正确的是( )
| A. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | 用0.2000 mol•L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol•L-1),当pH=7时,溶液中的酸恰好完全中和 | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol•L-1盐酸、③0.1 mol•L-1氯化镁溶液、④0.1 mol•L-1硝酸银溶液中,Ag+浓度:④>①>②>③ |
7.已知 25℃时有关弱酸的电离平衡常数:则下列说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A. | 等物质的量浓度的各溶液 pH 关系为:pH ( NaCN)>pH(Na2CO3)>pH( CH3COONa) | |
| B. | 浓度均为0.2mol/L NaHCO3和 Na2CO3溶液中,存在的粒子种类不相同 | |
| C. | 0.4 mol•L-1HCN 溶液与 0.2 mol•L-1NaOH 溶液等体积混合后,所得溶液中:c(Na+)>c(OH-)>c(H+) | |
| D. | 25℃时,pH=4且浓度均为0.1 mol•L-1的 CH3COOH、CH3COONa混合溶液中:c(Na+)+c(H+)>c(CH3COO-)+c(CH3COOH) |
14.对于常温下pH=12的氨水,下列说法正确的是( )
| A. | 由水电离产生的c(OH-)=10-12mol•L-1 | |
| B. | 向溶液中加入等体积的pH=2盐酸后溶液呈酸性 | |
| C. | 向溶液中加入稀盐酸可以促进氨水的电离,溶液的碱性增强 | |
| D. | 向溶液中加入适量盐酸使混合液的pH=7,混合液中c(NH4+)>c(Cl-) |
12.下列关于有机物的性质与结论都正确的是( )
| 选项 | 性质 | 结论 |
| A | 乙烯分别通入酸性高锰酸钾和溴的四氯化碳溶 液,两溶液都褪色 | 这两个反应类型相同 |
| B | 油脂、多糖、蛋白质都能水解 | 三者都是天然高分子化合物 |
| C | 乙醇和乙酸都能和钠反应 | 两者的结构中都含有羟基 |
| D | 葡萄糖和乙醛都能和新制的氢氧化铜反应 | 两者的结构中都含有醛基 |
| A. | A | B. | B | C. | C | D. | D |
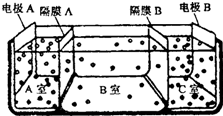
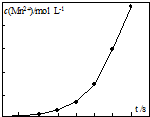 草酸钠滴定法测定高锰酸钾的质量分数步骤如下:
草酸钠滴定法测定高锰酸钾的质量分数步骤如下: