题目内容
9.在溶液导电性实验装置里在相同温度下分别注入20mL 6mol•L-1醋酸和20mL6mol•L-1氨水,灯光明暗程度相同,如果把这两种溶液混和后再试验则( )| A. | 灯光变暗;二者电离常数相同 | B. | 灯光变暗;电离常数醋酸大于氨水 | ||
| C. | 灯光变亮;电离常数醋酸小于氨水 | D. | 灯光变亮;电离常数醋酸等于氨水 |
分析 电解质溶液导电性取决于离子浓度的大小,醋酸和氨水两者混合生成强电解醋酸铵,导电能力增强.
解答 解:在相同温度下分别注入20mL 6mol•L-1醋酸和20mL6mol•L-1氨水,灯光明暗程度相同,说明两溶液中离子浓度一样,电离常数醋酸等于氨水;醋酸和氨水两者混合生成强电解醋酸铵,完全电离,自由移动离子浓度变大,导电能力增强,灯光变亮,故选D.
点评 本题考查了离子方程式的判断和溶液导电性比较,电解质溶液导电性取决于离子浓度的大小,题目难度中等.

练习册系列答案
相关题目
19. 下列实验操作正确的是( )
下列实验操作正确的是( )
 下列实验操作正确的是( )
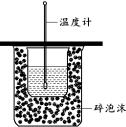
下列实验操作正确的是( )| A. | 用图装置测定中和热 | |
| B. | 将同浓度的FeCl3溶液和CuSO4溶液分别滴入H2O2中,滴入FeCl3溶液的H2O2更快产生气泡.不能得出结论对H2O2分解的催化效果Fe3+>Cu2+ | |
| C. | 研究H+浓度对该平衡:Cr2O72-+H2?2CrO42-+2H+的影响,往5mL 0.1mol/L K2CrO4溶液加入5mL 0.1mol/L的稀硫酸 | |
| D. | 测定溶液的pH值时,用玻璃棒蘸取少量溶液点在湿润的pH试纸上再与标准比色卡对照 |
20.常温下设a代表Ba(OH)2,b代表NaOH溶液,c代表NH3•H2O溶液.下列说法正确的是( )
| A. | 同物质的量浓度的三种溶液的pH:a=b>c | |
| B. | 同pH时,三种溶液稀释相同倍数后,pH:a=b<c | |
| C. | 同pH、同体积的三种溶液消耗同浓度盐酸的体积:a=b=c | |
| D. | 同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c |
14.下列两种溶液混合后,所得溶液中各离子浓度关系不 正确的是( )
| A. | 0.1 mol/L的NaOH溶液与0.1 mol/L的CH3COOH溶液等体积混合c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| B. | 常温下,0.01 mol/L的NaOH溶液与pH=2的CH3COOH溶液等体积混合c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 常温下,0.1 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液混合后使pH=7,c(CH3COO-)═c(Na+)>c(H+)=c(OH-) | |
| D. | 0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等体积混合c(CH3COO-)+c(OH-)═c(Na+)+c(H+) |
1.2008北京奥运会圆满结束,其中“祥云”火炬燃料是丙烷(C3H8)气体.以丙烷、氧气和CO2及熔融碳酸盐可制作新型燃料电池,电池的总反应式为:C3H8+5O2═3CO2+4H2O.下列说法正确的是( )
| A. | 每消耗1 mol C3H8可以向外电路提供12 mol e- | |
| B. | 负极通入C3H8,发生还原反应 | |
| C. | 正极通入氧气和CO2,正极反应式是:O2+2CO2+4e-═2CO32- | |
| D. | CO32-移向电池的正极 |
18.下列说法或表述中正确的是( )
| A. | 甲烷、甲醛、甲酸都不存在同分异构体,则甲醚(CH3OCH3)也无同分异构体 | |
| B. | 淀粉、油脂、蛋白质、纤维素都能在人体内水解,也能在体内氧化提供能量 | |
| C. | 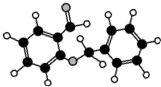 如图所示的有机物分子式为C14H12O2,能发生银镜反应 | |
| D. | 在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH |