题目内容
6.常温下,下列有关电解质溶液的说法,正确的是( )| A. | 1mol/L的CH3COOH溶液和0.1mol/L的CH3COOH溶液,水的电离程度前者大于后者 | |
| B. | pH=2的HA溶液和pH=12的NaOH溶液等体积混合后溶液显碱性,则混合后的溶液中存在平衡:A-+H2O?HA+OH- | |
| C. | 已知同浓度的NaA、NaB、NaX溶液碱性逐渐增强,则Ks(HA)<Ks(HB)<Ks(HX) | |
| D. | 已知常温下AgCl的Ksp=1.56×10-10,则浓度均为2.2×10-5mol/L的AgNO3溶液、NaCl溶液等体积混合,会产生AgCl白色沉淀 |
分析 A.醋酸存在电离平衡,将其浓度稀释10倍,因电离平衡正向移动,c(H+)大于原来溶液中c(H+)的$\frac{1}{10}$,酸抑制水的电离;
B.pH=2的HA溶液和pH=12的NaOH溶液等体积混合后,若HA为强酸溶液显中性,若HA为弱酸溶液显酸性;
C.同浓度的NaA、NaB、NaX溶液,盐水解程度越大,碱性逐渐增强,说明对应酸的酸性HA>HB>HC,据此分析电离平衡常数大小;
D.常温下AgCl的Ksp=1.56×10-10,计算此时浓度幂次方乘积和Ksp比较判断.
解答 解:A.1mol/L的CH3COOH溶液和0.1mol/L的CH3COOH溶液,醋酸存在电离平衡,将其浓度稀释10倍,因电离平衡正向移动,溶液中氢离子浓度减小,对水的抑制沉淀减小,所以水的电离程度前者小于后者,故A错误;
B.pH=2的HA溶液和pH=12的NaOH溶液等体积混合后,若HA为强酸溶液显中性,若HA为弱酸溶液显酸性,溶液不可能下碱性,故B错误;
C.同浓度的NaA、NaB、NaX溶液碱性逐渐增强说明对应酸的酸性HA>HB>HC,酸越强电离平衡常数越大,Ks(HA)>Ks(HB)>Ks(HX),故C错误;
D.已知常温下AgCl的Ksp=1.56×10-10,则浓度均为2.2×10-5mol/L的AgNO3溶液、NaCl溶液等体积混合,c(Ag+)c(Cl-)=2.2×10-5mol/L×2.2×10-5mol/L=4.84×10-5>Ksp,会产生AgCl白色沉淀,故D正确;
故选D.
点评 本题考查了弱电解质电离平衡和影响因素分析、溶度积常数的计算、盐类水解等知识点,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
17.将106g的Na2CO3和84gNaHCO3先经充分强热后,再分别与足量的盐酸反应,下列说法错误的是( )
| A. | 放出CO2的总量一样多 | B. | 前者生成的NaCl是后者的二倍 | ||
| C. | 消耗盐酸一样多 | D. | 后者消耗盐酸是前者的一半 |
14.下列离子方程式的书写正确的是( )
| A. | Al2O3和NaOH溶液反应:Al2O3+2OH-=2AlO2-+H2↑ | |
| B. | 过氧化钠固体与水反应:2O22-+2H2O═4OH-+O2↑ | |
| C. | 氯气溶于水:Cl2+H2O=2H++Cl-+ClO- | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
1.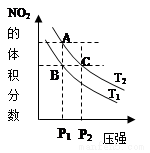 反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
 反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )| A. | 若恒温恒容时充入氩气,平衡向逆反应方向移动 | |
| B. | A、C两点气体的颜色:A深,C浅 | |
| C. | 由状态B到状态A,可以用加热的方法 | |
| D. | 因为B、C两点NO2的体积分数相同,所以化学平衡常数KB=KC. |
9.某燃料电池是以苯酚(C6H6O)为燃料,微生物为媒介的一种燃料电池,总反应方程式为C6H6O+7O2$\frac{\underline{\;微生物\;}}{\;}$6CO2+3H2O.下列有关说法正确的是( )
| A. | 苯酚在正极,发生氧化反应 | |
| B. | O2在负极,发生还原反应 | |
| C. | 反应结束后,电解液的酸度可能略有增加 | |
| D. | 正极的电极反应是C6H6O+11H2O-28e-═6CO2+28H+ |
6.互为同分异构体的物质不可能( )
| A. | 组成元素相同 | B. | 具有相同的分子式 | ||
| C. | 具有相同的熔点沸点和密度 | D. | 具有相同的相对分子质量 |
7.将足量的X气体通入Y溶液中,实验结果与预测的现象一致的组合是( )
| X气体 | Y溶液 | 预测的现象 | 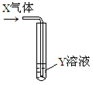 | |
| ① | CO2 | 饱和CaCl2溶液 | 白色沉淀析出 | |
| ② | SO2 | Ba(NO3)2溶液 | 白色沉淀析出 | |
| ③ | NH3 | AgNO3溶液 | 白色沉淀析出 | |
| ④ | NO2 | Na2S溶液 | 白色沉淀析出 |
| A. | 只有①②③ | B. | 只有①② | C. | 只有② | D. | ②④ |
 A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去).
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去).




