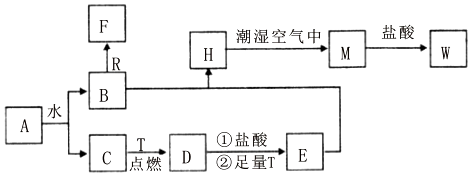
题目内容
2.实验室加热约150mL液体时,可以使用的仪器是( )| ① | ② | ③ | ④ | ⑤ | ⑥ |
 |  |  |  |  |  |
| A. | ①③④⑥ | B. | ②③④⑥ | C. | ①③④⑤ | D. | ②③⑤⑥ |
分析 加热约150mL液体,故应用到容积较大的烧杯,而烧杯加热必须垫石棉网,据此分析所需的仪器.
解答 解:由于加热的是约150mL液体,溶液的体积较大,故应用到容积较大的烧杯,而不能用试管;
而烧杯加热必须垫石棉网,且加热的装置应选择酒精灯,夹持装置应选择铁架台,故选A.
点评 本题考查了实验室中常见的液体加热实验仪器的选择,关键是根据液体的体积来选择合适的容器,从而做出一系列对应的选择.

练习册系列答案
相关题目
1.下列关于指定粒子构成的描述中,不正确的是( )
| A. | 14Cl与16O具有相同的中子数 | |
| B. | ${\;}_{50}^{119}Sn$与${\;}_{82}^{207}Pb$具有相同最外层电子数 | |
| C. | NH4+与OH-具有相同的质子数和电子数 | |
| D. | O22-和S2-具有相同的质子数和电子数 |
19.下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是( )
| 编号 | 化学反应 | 离子方程式 | 评价 |
| A | 碳酸钙与盐酸 | CO32-+2H+=H2O+CO2↑ | 错误,碳酸钙是弱电解质,不应写成离子形式 |
| B | 向次氯酸钙溶液通入过量CO2 | Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 正确 |
| C | 石灰水中滴加少量NaHCO3溶液 | Ca2++HCO3-+OH-=CaCO3↓+H2O | 错误,不满足Ca(OH)2的配比 |
| D | 过量铁屑溶于稀硝酸 | 3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O | 正确 |
| A. | A | B. | B | C. | C | D. | D |
6.常温下,下列有关电解质溶液的说法,正确的是( )
| A. | 1mol/L的CH3COOH溶液和0.1mol/L的CH3COOH溶液,水的电离程度前者大于后者 | |
| B. | pH=2的HA溶液和pH=12的NaOH溶液等体积混合后溶液显碱性,则混合后的溶液中存在平衡:A-+H2O?HA+OH- | |
| C. | 已知同浓度的NaA、NaB、NaX溶液碱性逐渐增强,则Ks(HA)<Ks(HB)<Ks(HX) | |
| D. | 已知常温下AgCl的Ksp=1.56×10-10,则浓度均为2.2×10-5mol/L的AgNO3溶液、NaCl溶液等体积混合,会产生AgCl白色沉淀 |
14.在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系,下列说法正确的是( )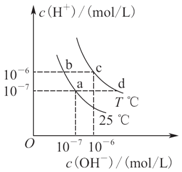

| A. | a点对应的溶液和c点对应的溶液pH大小:pH(c)>pH(a) | |
| B. | 如b点对应的溶液中只含NaHA,则溶液中粒子浓度大小:c(HA-)>c(H2A)>c(H+)>c(A2-) | |
| C. | 25℃时,Ka(HF)=3.6×10-4,Ka(CH3COOH)=1.75×10-5,0.1 mol/L的NaF溶液与0.1 mol/L的CH3COOK溶液相比: c(Na+)-c(F-)>c(K+)-c(CH3COO-) | |
| D. | d点对应的溶液中可大量存在:K+、Ba2+、NO3-、I- |
11.利用下列实验装置能完成对应实验的是( )
| A. |  量取20.00 mL Na2CO3溶液 | B. |  能证明非金属性 Cl>C>Si | ||
| C. | 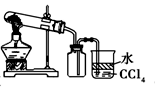 实验室制取并收集NH3 | D. | 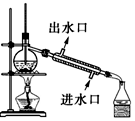 分离酒精与CCl4 |
12.根据表的数据,求H2(g)+Cl2(g)=2HCl(g)的反应热.
| 物质 | H2 | Cl2 | HCl |
| 键能/(KJ/mol-1) | 436 | 243 | 431 |