题目内容
6.互为同分异构体的物质不可能( )| A. | 组成元素相同 | B. | 具有相同的分子式 | ||
| C. | 具有相同的熔点沸点和密度 | D. | 具有相同的相对分子质量 |
分析 具有相同分子式、不同结构的物质之间互为同系物,则互为同分异构体的物质的分子式、相对分子质量、含有元素一定相同,但是具有的性质一定不同,据此进行解答.
解答 解:A.互为同分异构体的物质具有相同分子式,则含有元素一定相同,故A不选;
B.互为同分异构体的物质的分子式一定相同,故B不选;
C.互为同分异构体的物质结构不同,则具有相同的熔点沸点和密度不可能相同,故C选;
D.互为同分异构体的物质具有相同分子式,则一定具有相同的相对分子质量,故不选;
故选C.
点评 本题考查了同分异构体的判断,题目难度不大,明确同分异构体的概念为解答关键,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.

练习册系列答案
相关题目
5.下列物质的俗称表示同一物质的是( )
| A. | 明矾、胆矾 | B. | 冰、干冰 | C. | 火碱、烧碱 | D. | 苏打、小苏打 |
6.常温下,下列有关电解质溶液的说法,正确的是( )
| A. | 1mol/L的CH3COOH溶液和0.1mol/L的CH3COOH溶液,水的电离程度前者大于后者 | |
| B. | pH=2的HA溶液和pH=12的NaOH溶液等体积混合后溶液显碱性,则混合后的溶液中存在平衡:A-+H2O?HA+OH- | |
| C. | 已知同浓度的NaA、NaB、NaX溶液碱性逐渐增强,则Ks(HA)<Ks(HB)<Ks(HX) | |
| D. | 已知常温下AgCl的Ksp=1.56×10-10,则浓度均为2.2×10-5mol/L的AgNO3溶液、NaCl溶液等体积混合,会产生AgCl白色沉淀 |
14.在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系,下列说法正确的是( )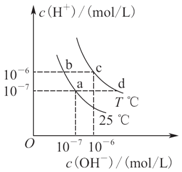

| A. | a点对应的溶液和c点对应的溶液pH大小:pH(c)>pH(a) | |
| B. | 如b点对应的溶液中只含NaHA,则溶液中粒子浓度大小:c(HA-)>c(H2A)>c(H+)>c(A2-) | |
| C. | 25℃时,Ka(HF)=3.6×10-4,Ka(CH3COOH)=1.75×10-5,0.1 mol/L的NaF溶液与0.1 mol/L的CH3COOK溶液相比: c(Na+)-c(F-)>c(K+)-c(CH3COO-) | |
| D. | d点对应的溶液中可大量存在:K+、Ba2+、NO3-、I- |
1.同位素示踪法可用于反应机理的研究,下列反应中同位素示踪表示正确的是( )
| A. | 2Na218O2+2CO2═2Na2Cl8O3+O2 | |
| B. | NH4Cl+2H2O?NH3•H2O+HCl | |
| C. | K37ClO3+6HCl═K37Cl+3Cl2↑+3H2O | |
| D. | 2KMnO4+5H218O2+3H2SO4═K2SO4+2MnSO4+518O2↑+8H2O |
11.利用下列实验装置能完成对应实验的是( )
| A. |  量取20.00 mL Na2CO3溶液 | B. |  能证明非金属性 Cl>C>Si | ||
| C. | 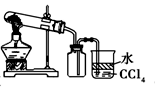 实验室制取并收集NH3 | D. | 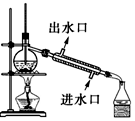 分离酒精与CCl4 |
15.如图1方框中的字母表示有关的一种反应物或生成物(某些物质略去),A~I的所有物质均是由1~18号元素组成的单质或化合物,其中只有D为单质,且气体混合物X各成分物质的量相等.
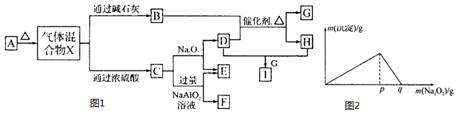
(1)物质A的名称为碳酸氢铵.物质A属于be(填字母)
a.正盐b.酸式盐c.复盐d.混合物e.电解质f.两性氢氧化物
(2)写出下列物质的化学式:FAl(OH)3,IHNO3.
(3)写出反应①的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
写出实验室制取气体H的离子方程式:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(4)将F与一定量盐酸混合,二者恰好反应得到溶液M,在M中加入Na2O2时,加入Na2O2的质量与产生沉淀的质量具有如图2所示关系,则p点时产生沉淀与放出气体的物质的量之比为4:3,从开始加Na2O2固体至q点的整个过程中,总反应的离子方程式为Al3++2Na2O2=4Na++A O2-+O2↑.
(5)将A和E组成的固体混合物Yg溶于水配成溶液,向其中慢慢滴入I的稀溶液,测得加入I溶液的体积与生成C的体积(标准状况)如表所示.则I溶液的物质的量浓度为1mol/L.

(1)物质A的名称为碳酸氢铵.物质A属于be(填字母)
a.正盐b.酸式盐c.复盐d.混合物e.电解质f.两性氢氧化物
(2)写出下列物质的化学式:FAl(OH)3,IHNO3.
(3)写出反应①的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
写出实验室制取气体H的离子方程式:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(4)将F与一定量盐酸混合,二者恰好反应得到溶液M,在M中加入Na2O2时,加入Na2O2的质量与产生沉淀的质量具有如图2所示关系,则p点时产生沉淀与放出气体的物质的量之比为4:3,从开始加Na2O2固体至q点的整个过程中,总反应的离子方程式为Al3++2Na2O2=4Na++A O2-+O2↑.
(5)将A和E组成的固体混合物Yg溶于水配成溶液,向其中慢慢滴入I的稀溶液,测得加入I溶液的体积与生成C的体积(标准状况)如表所示.则I溶液的物质的量浓度为1mol/L.
| I溶液的体积(mL) | 4 | 8 | 15 | 20 | 50 | 120 | 150 |
| C的体积(mL) | 0 | 0 | 112 | 224 | 896 | 2240 | 2240 |