题目内容
19.向四支试管中分别加入少量不同的无色溶液进行如下操作,现象和结论正确的是( )| 操作 | 现象 | 结论 | |
| A | 先滴加BaCl2溶液再滴加HCl溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 先滴加稀盐酸再滴加AgNO3溶液 | 生成白色沉淀 | 原溶液中有Cl- |
| C | 用洁净铁丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有K+ |
| D | 滴加NaOH溶液加热,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 原溶液中有NH4+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.白色沉淀可能为AgCl或硫酸钡;
B.白色沉淀可能为硫酸银;
C.观察钾的焰色反应需要透过蓝色的钴玻璃;
D.氨气可使湿润红色石蕊试纸变蓝.
解答 解:A.白色沉淀可能为AgCl或硫酸钡,则原溶液中不一定有SO42-,故A错误;
B.白色沉淀可能为硫酸银,则原溶液中不一定有Cl-,故B错误;
C.观察钾的焰色反应需要透过蓝色的钴玻璃,没有透过蓝色的钴玻璃,则原溶液中不一定有K+,故C错误;
D.氨气可使湿润红色石蕊试纸变蓝,则原溶液中有NH4+,故D正确;
故选D.
点评 本题考查常见离子的检验,为高频考点,把握离子检验的试剂、现象和结论为解答的关键,侧重分析与实验能力的考查,注意离子检验时排除干扰离子,题目难度不大.

练习册系列答案
相关题目
10.配制下列溶液时常需加入少量括号内的物质,其中不是为了抑制离子水解的是( )
| A. | NaAlO2(NaOH) | B. | SnCl2(HCl) | C. | FeCl3(HCl) | D. | FeSO4(Fe) |
7.有关NaHCO3与Na2CO3的性质,下列叙述中错误的是( )
| A. | Na2CO3和NaHCO3粉末与同浓度盐酸反应,Na2CO3碱性强,反应放出气体速度快 | |
| B. | 等物质的量的两种盐与同浓度的盐酸反应,Na2CO3消耗盐酸的体积是NaHCO3的两倍 | |
| C. | 向Na2CO3饱和溶液中通入过量CO2,有NaHCO3结晶析出 | |
| D. | Na2CO3和NaHCO3溶液分别和BaCl2溶液反应,现象不同 |
14.一定条件下的可逆反应2SO2+O2?2SO3,下列判断能说明达到化学反应的限度的是( )
| A. | SO2完全转化为SO3 | |
| B. | SO2、O2与SO3的物质的量之比为2:1:2 | |
| C. | 反应混合物中,SO3的质量分数不再改变 | |
| D. | 消耗2 mol SO2的同时生成2 mol SO3 |
4.设NA为阿伏加罗常数的值,下列说法正确的是( )
| A. | 常温常压下,22.4LCO2所含的原子数为3NA | |
| B. | 1molCl2与足量的Fe完全反应,转移的电子数为2NA | |
| C. | 0.5molC2H2和C6H6的气态混合物中所含原子总数为2NA | |
| D. | 2L1mol/L的盐酸中所含HCl分子数约为2NA |
8.已知次氯酸是比碳酸还弱的酸,反应Cl2+H2O?HCl+HClO达到平衡后,要使HClO浓度增大,可加入( )
| A. | NaCl固体 | B. | 水 | C. | CaCO3固体 | D. | NaOH固体 |

 .
. 与Br2,要想得到纯净的该产物,可用NaOH溶液(或水)洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.
与Br2,要想得到纯净的该产物,可用NaOH溶液(或水)洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.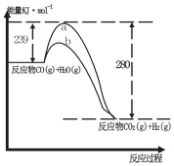 (1)已知在25℃,101KPa时,1gH2(g)完全燃烧生成液态水时放出143KJ的热量,试写出表示氢气燃烧热的热化学方程式:2H2(g)+O2(g)=2H2O(1)△H=-572kJ•mol-1
(1)已知在25℃,101KPa时,1gH2(g)完全燃烧生成液态水时放出143KJ的热量,试写出表示氢气燃烧热的热化学方程式:2H2(g)+O2(g)=2H2O(1)△H=-572kJ•mol-1