题目内容
8.2015年8月12日,天津滨海新区爆炸事故确认有氰化钠、亚硝酸钠等,氰化钠毒性很强,遇水、酸会产生有毒易燃氰化氢气体.氰化氢的沸点只有26摄氏度,因此相当容易挥发进入空气,这就大大增加了中毒的风险.同时氰化钠遇到亚硝酸钠会发生爆炸.回答下列问题(1)写出氰化钠遇水产生氰化氢的离子方程式CN-+H2O?HCN+OH-.
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理.氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式NaCN+H2O2+H2O═NaHCO3+NH3↑.
(3)氰化钠遇到亚硝酸钠能生成两种气体发生爆炸,写出化学反应方程式3NaCN+5NaNO2═3CO2↑+4N2↑+4Na2O.
(4)爆炸残留在废水中的CN-可以用Cr2O72-处理,拟定如图流程进行废水处理,
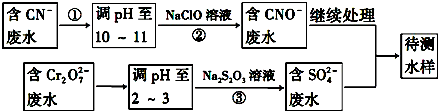
(1)上述处理废水流程中主要使用的方法是d;
a.混凝法b.中和法 c.沉淀法d.氧化还原法
(2)②中反应后无气体放出,该反应的离子方程式为CN-+ClO-═CNO-+Cl-;
(3)步骤③中,每处理0.4mol Cr2O72-时转移电子2.4mol,该反应的离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O
(4)处理酸性Cr2O72-废水多采用铁氧磁体法.该法是向废水中加入FeSO4•7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于FeⅡ[FexⅢCr(2-x)Ⅲ]O4(铁氧磁体,罗马数字表示元素价态)的沉淀.处理1mol Cr2O72-,需加入amol FeSO4•7H2O,下列结论正确的是D.
A.x=0.5,a=6 B.x=0.5,a=10 C.x=1.5,a=6 D.x=1.5,a=10.
分析 (1)氰化钠易发生水解产生氰化氢;
(2)氰化钠与双氧水反应生成氨气和碳酸氢钠;
(3)氰化钠遇到亚硝酸钠会生成两种气体发生爆炸,气体为二氧化碳和氮气,结合质量守恒书写化学方程式;
(4)流程分析含CN-废水调整溶液PH加入NaClO溶液,氧化CN-离子反应生成CNO-的废水,含Cr2O72-的废水调整溶液PH加入Na2S2O3发生氧化还原反应得到含硫酸根离子的废水,和含CNO-的废水继续处理得当待测水样.
(1)从流程分析物质的转化关系和试剂选择分析所用方法;
(2)碱性条件下,CN-离子与NaClO发生氧化还原反应生成CNO-、Cl-离子,据此写出离子方程式;
(3)利用每0.4molCr2O72-转移2.4mol的电子来计算被还原后Cr元素的化合价,再书写离子方程式;
(4)根据氧化还原反应中得失电子数相等,再结合原子守恒进行计算.
解答 解:(1)氰化钠易发生水解产生氰化氢,方程式为CN-+H2O?HCN+OH-,故答案为:CN-+H2O?HCN+OH-;
(2)氰化钠与双氧水反应生成氨气和碳酸氢钠,方程式为NaCN+H2O2+H2O═NaHCO3+NH3↑,故答案为:NaCN+H2O2+H2O═NaHCO3+NH3↑;
(3)氰化钠遇到亚硝酸钠会生成两种气体发生爆炸,气体为二氧化碳和氮气,反应的方程式为3NaCN+5NaNO2=3CO2↑+4N2↑+4Na2O,故答案为:3NaCN+5NaNO2=3CO2↑+4N2↑+4Na2O;
(4)流程分析含CN-废水调整溶液PH加入NaClO溶液,氧化CN-离子反应生成CNO-的废水,含Cr2O72-的废水调整溶液PH加入Na2S2O3发生氧化还原反应得到含硫酸根离子的废水,和含CNO-的废水继续处理得当待测水样.
(1)从流程看,CN-转化为CNO-,化合价升高被氧化剂氧化,Cr2O72-转化为Cr3+化合价降低,故还原剂还原,故采用方法为氧化-还原法;
故答案为:d;
(2)步骤②中,无气体放出,CN-被ClO-氧化为CNO-,则因为是在碱性环境中,故ClO-只能被还原为Cl-,反应式为:CN-+ClO-═CNO-+Cl-;
故答案为:CN-+ClO-═CNO-+Cl-;
(3)每0.4molCr2O72-转移2.4mol的电子,设还原后Cr元素的化合价为x,则0.4mol×2×(6-x)=2.4mol,解得x=+3,则离子反应为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O,
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
(4)处理1mol Cr2O72-,需加入a mol FeSO4•7H2O,根据铬原子守恒得,1mol Cr2O72-完全反应后生成 $\frac{2}{2-x}$molFeⅡ[FeⅢx•CrⅢ2-x]O4,根据铁原子守恒得amol=$\frac{2(1+x)}{2-x}$mol①,该反应中得失电子数相等,1mol×2×3=$\frac{2}{2-x}$mol×(3-2)×x,解得x=1.5,将x=1.5代入①得a=10,
故答案为:D.
点评 本题考查物质的分离和提纯,为高频考点,涉及实验基本操作、氧化还原反应等知识点,明确流程图中化学反应原理、基本操作方法是解本题关键,难点是(4)的氧化还原反应的计算,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 丙烯 | B. | 1-丁烯 | C. | 1-戊烯 | D. | 3-甲基-2-戊烯 |
| A. | 1mol O | B. | 1mol O2 | C. | 1mol氧原子 | D. | 1摩尔小麦 |
①A、B、C的物质的量之比为1:2:2
②A、B、C的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成nmolC,同时生成2nmolB
⑤v正(A)=v逆(C)
⑥混合气体的密度不再发生变化
⑦混合气体的平均相对分子质量不再发生变化.
| A. | ①②⑦ | B. | ②④⑥ | C. | ②③⑦ | D. | ③④⑤ |
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示.其总反应的化学方程式为CO2$\frac{\underline{\;△或太阳能\;}}{FeO}$C+O2.

(2)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2C02(g)+6H2(g)?CH2=CH2(g)+4H20(g)△H,
几种物质的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
| 物质 | H2(g) | CO2(g) | CH2=CH2(g) | H2O(g) |
| 能量/kJ•mol-1 | 0 | -394 | 52 | -242 |
(3)在2L恒容密闭容器中充入2molCO2和nmol H2,在一定条件下发生(2)中的反应,CO2的转化率与温度、投料比[X=$\frac{n({H}_{2})}{n(C{O}_{2})}$]的关系如图2所示.
①X1> X2(填“>”、“<”或“=”,下同),平衡常数KA> KB.
②若B点的投料比为3,且从反应开始到B点需要10min,则v(H2)=0.225mol/(L.min).
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如图3.
①b电极的名称是正极.
②产生丙烯的电极反应式为3CO2+18H++18e-=CH3CH=CH2+6H2O.
| A. | 元素原子第一电离能大小关系:Z>Y>W>X>M | |
| B. | XZ2、X2M2、W2Z2均为直线形的共价化合物 | |
| C. | Y与M形成化合物键长大于Z与M形成化合物的键长 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
| A. | 液氯和氯水 | B. | 漂白粉和乙醇 | ||
| C. | 饱和食盐水和硫酸亚铁 | D. | 干冰和混有冰的水 |
| A. | 混合溶液中由水电离出来的c(OH-)=1×10-9mol/L | |
| B. | c(OH-)-c(HY)=c(H+)=1×10-5mol/L | |
| C. | 混合溶液中c(Na+)=c(Y-)+c(HY)=0.15mol/L | |
| D. | 混合溶液中离子浓度大小次序为:c(Y-)>c(Na+)>c(OH-)>c(H+) |