题目内容
2.元素周期律是哪一位科学家发现的?其内容是什么?后经哪一位科学家做了修改?其内容是什么?分析 俄国著名化学家门捷列夫根据原子量的大小,将元素进行分类排队,发现元素性质随原子量的递增呈明显的周期变化的规律;莫斯莱用实验证明了元素的主要特性由其原子序数决定,而不是由原子量决定.
解答 解:元素周期律是由俄国化学家门捷列夫发现的,其内容为:元素性质随相对原子质量的递增而呈周期性变化,后经莫斯莱修订,内容为:元素性质随原子序数的递增而呈周期性变化,
故答案为:门捷列夫;元素性质随相对原子质量的递增而呈周期性变化;莫斯莱;元素性质随原子序数的递增而呈周期性变化.
点评 本题考查元素周期律、化学史,属于识记知识的考查,中学没有涉及莫斯莱是原子序数的发现者,属于易错题目.

练习册系列答案
相关题目
3.化学与生活密切相关.下列说法不正确的是( )
| A. | 乙烯可用作水果的催熟剂 | |
| B. | 二氧化硫可用作食品的漂白剂 | |
| C. | 交警可用酸性重铬酸钾来检测司机是否酒驾 | |
| D. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
4.下列说法中正确的是( )
| A. | 有离子键的化合物中一定没有共价键 | |
| B. | 有共价键的化合物中一定没有离子键 | |
| C. | 物质的熔化过程可能既破坏离子键又破坏共价键 | |
| D. | 物质的熔化过程可能不破坏任何化学键 |
14.几种短周期元素的原子半径及主要化合价如表:
下列叙述正确的是( )
| 元素代号 | L | M | X | R | T |
| 原子半径(nm) | 0.110 | 0.113 | 0.102 | 0.075 | 0.071 |
| 主要化合价 | +5-3 | +3 | +6-2 | +5-3 | -2 |
| A. | 离子半径大小:r(M3+)>r(T2-) | B. | 氢化物稳定性:L<R | ||
| C. | X与T只能形成一种化合物 | D. | 含有M的化合物一定是离子化合物 |
11.短周期主族元素X、Y、Z、W的原子序数依次增大.X与W同主族,X、W的单质在标准状况下的状态不同.Y是空气中含量最高的元素,Z原子最外层电子数是其内层电子总数的3倍,Z2-与W+具有相同的电子层结构.下列说法正确的是( )
| A. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X),离子半径大小顺序:r(Z2-)>r(W+) | |
| B. | 元素Y的简单气态氢化物的热稳定性和熔沸点都比Z的高 | |
| C. | 由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性 | |
| D. | 化合物X2Z2与W2Z2所含化学键类型完全相同 |
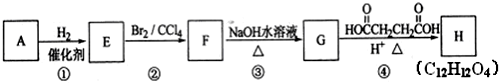
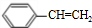 +Br2→
+Br2→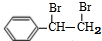
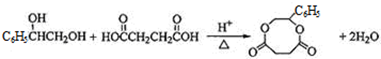
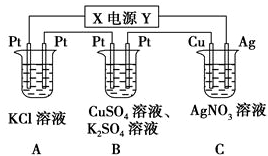
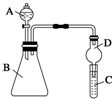 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.