题目内容
6.根据元素周期表1-20号元素的性质和递变规律,回答下列问题.(1)属于金属元素的有7种,金属性最强的元素与氧反应生成的化合物有K2O、K2O2(填两种化合物的化学式);
(2)属于稀有气体的是He、Ne、Ar(填元素符号,下同);
(3)形成化合物种类最多的两种元素是C、H;
(4)第三周期中,原子半径最大的是(稀有气体除外)Na;
(5)推测Si、N最简单氢化物的稳定性NH3大于SiH4(填化学式);
(6)除稀有气体外,原子半径最小的元素是H;
(7)最高正价与最低负价代数和等于4的元素是S.
分析 1-20号元素中,只有Li、Be、Na、Mg、Al、K、Ca为金属,K的金属性最强,与氧气反应生成氧化钾、过氧化钾;只有He、Ne、Ar为稀有气体,
(1)1-20号元素,Li、Be、Na、Mg、Al、K、Ca为金属元素;
(2)1-20号元素,稀有气体有3种元素;
(3)有机化合物的种类最多;
(4)第三周期中,原子半径从左向右逐渐减小;
(5)非金属性越强,气态氢化物越稳定;
(6)短周期中H的原子半径最小;
(7)最高正价与最低负价代数和等于4,可知最高价为+6价,最低价为-2价,以此来解答.
解答 解:元素周期表1-20号中,
(1)1-20号元素中,只有Li、Be、Na、Mg、Al、K、Ca为金属,属于金属元素的有7种,金属性最强的元素与氧反应生成的化合物有K2O和K2O2,
故答案为:7;K2O、K2O2;
(2)属于稀有气体的是He、Ne、Ar,故答案为:He、Ne、Ar;
(3)有机化合物的种类最多,主要含C、H元素,故答案为:C、H;
(4)第三周期中,原子半径从左向右逐渐减小,则Na的原子半径最大,故答案为:Na;
(5)非金属性越强,气态氢化物越稳定,非金属性N>Si,则稳定性为NH3>SiH4,故答案为:NH3;SiH4;
(6)除稀有气体外,原子半径最小的元素是H,故答案为:H;
(7)最高正价与最低负价代数和等于4的元素是S,故答案为:S.
点评 本题考查位置、结构与性质的应用,为高频考点,把握元素的位置、性质、元素化合物为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.

练习册系列答案
相关题目
14.几种短周期元素的原子半径及主要化合价如表:
下列叙述正确的是( )
| 元素代号 | L | M | X | R | T |
| 原子半径(nm) | 0.110 | 0.113 | 0.102 | 0.075 | 0.071 |
| 主要化合价 | +5-3 | +3 | +6-2 | +5-3 | -2 |
| A. | 离子半径大小:r(M3+)>r(T2-) | B. | 氢化物稳定性:L<R | ||
| C. | X与T只能形成一种化合物 | D. | 含有M的化合物一定是离子化合物 |
1.下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号、化学式或化学用语回答以下问题:
(1)在这些元素中,非金属性最强的元素是F(填符号或化学式,下同),
(2)元素的最高价氧化物对应的水化物中酸性最强的酸是HClO4,呈两性的氢氧化物是Al(OH)3.
(3)⑤的单质与元素的最高价氧化物对应的水化物中碱性最强的碱溶液反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)元素的最高价氧化物对应的水化物中酸性最强的酸是HClO4,呈两性的氢氧化物是Al(OH)3.
(3)⑤的单质与元素的最高价氧化物对应的水化物中碱性最强的碱溶液反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
11.短周期主族元素X、Y、Z、W的原子序数依次增大.X与W同主族,X、W的单质在标准状况下的状态不同.Y是空气中含量最高的元素,Z原子最外层电子数是其内层电子总数的3倍,Z2-与W+具有相同的电子层结构.下列说法正确的是( )
| A. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X),离子半径大小顺序:r(Z2-)>r(W+) | |
| B. | 元素Y的简单气态氢化物的热稳定性和熔沸点都比Z的高 | |
| C. | 由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性 | |
| D. | 化合物X2Z2与W2Z2所含化学键类型完全相同 |
18.有机物分子的基团之间存在一定影响,相关叙述不正确的是( )
| A. | 钠与乙醇反应不如与水反应活泼,体现了羟基对乙基的影响 | |
| B. | 在溴乙烷分子中,溴原子与乙基之间的影响是相互的 | |
| C. | 苯酚比苯更容易发生苯环上的取代反应,体现了羟基对苯基的影响 | |
| D. | 苯酚与溴水作用可得三溴苯酚,而苯与纯溴作用,要在催化剂作用下才只得到一溴代物 |
15.X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若X原子的最外层电子数比其次外层电子数多3个,下列说法不正确的是( )
| X | Y | |
| Z | W |
| A. | 原子半径:Z>X>Y | |
| B. | Y的最高正价与最低负价的和是4 | |
| C. | W的单质是工业制取盐酸的原料之一 | |
| D. | X、W的氢化物相遇会产生白烟 |
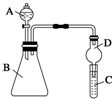 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.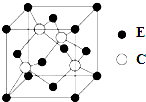 A、B、C、D、E为原子序数依次增大的四种元素,A的价电子层中的未成对电子有3个,B的最外层电子数为其内层电子数的3倍,C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,D元素最外层有一个未成对电子,E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.回答下列问题:
A、B、C、D、E为原子序数依次增大的四种元素,A的价电子层中的未成对电子有3个,B的最外层电子数为其内层电子数的3倍,C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,D元素最外层有一个未成对电子,E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.回答下列问题: .
.