题目内容
3.下列叙述中正确的是( )| A. | 离子化合物中一定不含非极性共价键 | |
| B. | 原子晶体的熔点一定高于其他晶体 | |
| C. | 金属晶体的堆积方式的空间利用率最低的是Po | |
| D. | 构成晶体的粒子一定含有化学键 |
分析 A.离子化合物中可含非极性共价键;
B.一般原子晶体的熔点高于其它晶体;
C.简单立方堆积(Po型)空间利用率为52%;
D.稀有气体的晶体中不含化学键.
解答 解:A.离子化合物中可含非极性共价键,如过氧化钠中含非极性共价键,故A错误;
B.一般原子晶体的熔点高于其它晶体,如金属晶体W的熔点高,故B错误;
C.简单立方堆积(Po型)空间利用率为52%,空间利用率最低,而体心立方堆积,属于钾、钠和铁型,空间利用率68%;六方最密堆积,属于镁、锌、钛型,空间利用率为74%,面心立方最密堆积(Cu型)空间利用率为74%,故C正确;
D.稀有气体的晶体中不含化学键,故D错误;
故选C.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列说法中正确的是( )
| A. | 有离子键的化合物中一定没有共价键 | |
| B. | 有共价键的化合物中一定没有离子键 | |
| C. | 物质的熔化过程可能既破坏离子键又破坏共价键 | |
| D. | 物质的熔化过程可能不破坏任何化学键 |
14.几种短周期元素的原子半径及主要化合价如表:
下列叙述正确的是( )
| 元素代号 | L | M | X | R | T |
| 原子半径(nm) | 0.110 | 0.113 | 0.102 | 0.075 | 0.071 |
| 主要化合价 | +5-3 | +3 | +6-2 | +5-3 | -2 |
| A. | 离子半径大小:r(M3+)>r(T2-) | B. | 氢化物稳定性:L<R | ||
| C. | X与T只能形成一种化合物 | D. | 含有M的化合物一定是离子化合物 |
11.短周期主族元素X、Y、Z、W的原子序数依次增大.X与W同主族,X、W的单质在标准状况下的状态不同.Y是空气中含量最高的元素,Z原子最外层电子数是其内层电子总数的3倍,Z2-与W+具有相同的电子层结构.下列说法正确的是( )
| A. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X),离子半径大小顺序:r(Z2-)>r(W+) | |
| B. | 元素Y的简单气态氢化物的热稳定性和熔沸点都比Z的高 | |
| C. | 由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性 | |
| D. | 化合物X2Z2与W2Z2所含化学键类型完全相同 |
18.有机物分子的基团之间存在一定影响,相关叙述不正确的是( )
| A. | 钠与乙醇反应不如与水反应活泼,体现了羟基对乙基的影响 | |
| B. | 在溴乙烷分子中,溴原子与乙基之间的影响是相互的 | |
| C. | 苯酚比苯更容易发生苯环上的取代反应,体现了羟基对苯基的影响 | |
| D. | 苯酚与溴水作用可得三溴苯酚,而苯与纯溴作用,要在催化剂作用下才只得到一溴代物 |
8.山梨酸是应用广泛的食品防腐剂,其结构如图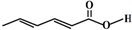 ,下列关于山梨酸的说法错误的是( )
,下列关于山梨酸的说法错误的是( )
 ,下列关于山梨酸的说法错误的是( )
,下列关于山梨酸的说法错误的是( )| A. | 分子式为C7H8O2 | |
| B. | 1mol该物质最多可与2mol Br2发生加成反应 | |
| C. | 可使酸性KMnO4溶液褪色 | |
| D. | 可与醇发生取代反应 |
15.X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若X原子的最外层电子数比其次外层电子数多3个,下列说法不正确的是( )
| X | Y | |
| Z | W |
| A. | 原子半径:Z>X>Y | |
| B. | Y的最高正价与最低负价的和是4 | |
| C. | W的单质是工业制取盐酸的原料之一 | |
| D. | X、W的氢化物相遇会产生白烟 |
13.如图所示的原子结构示意图中,能组成AB2型化合物的是( )


| A. | ①③ | B. | ②④ | C. | ②③ | D. | ①④ |