题目内容
下列说法正确的是( )
| A、已知20℃时,KNO3的溶解度为31.6g.则20℃时KNO3饱和溶液的质量分数等于31.6% |
| B、1mol/L的食盐溶液中含有58.5gNaCl |
| C、所有物质的溶解度随着温度的升高而上升 |
| D、实验室需要230mL 0.1mol/L的H2SO4溶液,应选用250mL容量瓶配制 |
考点:溶液中溶质的质量分数及相关计算,溶液的配制
专题:物质的量浓度和溶解度专题
分析:A、饱和溶液中,溶质的质量分数=
×100%;
B、根据m=cVM来计算;
C、根据物质的溶解度和温度之间的关系来解答;
D、根据容量瓶的选择原则来回答.
| 溶解度 |
| 100+溶解度 |
B、根据m=cVM来计算;
C、根据物质的溶解度和温度之间的关系来解答;
D、根据容量瓶的选择原则来回答.
解答:
解:A、20℃时,KNO3的溶解度为31.6g.则20℃时KNO3饱和溶液的质量分数=
×100%=24%,故A错误;
B、不知道溶液的体积,所以无法计算溶质的质量,故B错误;
C、大部分物质的溶解度随着温度的升高而上升,但是氯化钠的溶解度和温度的关系不大,还有物质的溶解度随温度的升高而降低,故C错误;
D、配制的溶液的体积是230mL,应该需要250mL的容量瓶,故D正确.
故选D.
| 31.6g |
| 100g+31.6g |
B、不知道溶液的体积,所以无法计算溶质的质量,故B错误;
C、大部分物质的溶解度随着温度的升高而上升,但是氯化钠的溶解度和温度的关系不大,还有物质的溶解度随温度的升高而降低,故C错误;
D、配制的溶液的体积是230mL,应该需要250mL的容量瓶,故D正确.
故选D.
点评:本题综合考查学生有关溶液中溶液质量分数的计算、溶液的配制以及物质的溶解度和温度之间的关系知识,属于综合知识的考查,难度不大.

练习册系列答案
 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
由乙炔为原料制取CHClBr-CH2Br,下列方法中最可行的是( )
| A、先与HBr加成后再与HCl加成 |
| B、先与H2完全加成后再与Cl2、Br2取代 |
| C、先与HCl加成后再与Br2加成 |
| D、先与Cl2加成后再与HBr加成 |
一定条件下,有关金属腐蚀的下列说法不正确的是( )
| A、钢铁制品腐蚀时正极反应:O2+2H2O+4e-=4OH- |
| B、在酸性较强的溶液中,金属主要发生析氢腐蚀 |
| C、为减缓金属腐蚀,可将要保护的金属物件与外电源的正极相连接 |
| D、在海轮外壳上附着一些锌块,则可以减缓海轮外壳的腐蚀 |
下列说法与盐类水解无关的是( )
| A、实验室配制FeCl3溶液时用盐酸溶解FeCl3固体 |
| B、向沸水中滴加饱和FeCl3溶液加热至红褐色制得Fe(OH)3胶体 |
| C、短期保存FeCl2溶液时向其中加入少量铁粉 |
| D、保存Na2CO3溶液的试剂瓶用橡胶塞而不能用玻璃塞 |
常温下,向一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,停止滴加,此时溶液pH=11.若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液体积之和,则所加入的NaHSO4溶液与Ba(OH)2溶液体积之比是( )
| A、1:4 | B、4:1 |
| C、1:9 | D、9:1 |
根据如图所给信息,得出的结论正确的是( )
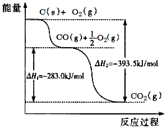

| A、48g碳完全燃烧放出热量为1574 kJ/mol |
| B、2C(s)+O2(g)═2CO(g)△H=-221.0kJ/mol |
| C、2CO2(g)═2CO(g)+O2(g)△H=+283.0kJ/mol |
| D、C(s)+O2(g)═CO2(s)△H=-393.5kJ/mol |
