题目内容
20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态.分析图(本题最下方)中信息,回答下列问题:

(1)图一是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ;在反应体系中加入催化剂,E1和E2的变化是:E1 减小,E2 减小(填“增大”、“减小”或“不变”),对反应热是否有影响? 不变.(填“是”或“否”)加入催化剂,改变反应的途径,降低反应所需的活化能
(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中的△H表示生成1mol产物的数据).根据图二回答下列问题:
①P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式
②P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2 等于?H1(填“大于”、“小于”或“等于”)反应中的能量变化只与起态、终态有关,与反应的途径无关.

(1)图一是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中的△H表示生成1mol产物的数据).根据图二回答下列问题:
①P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式
②P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2
考点:有关反应热的计算
专题:
分析:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量234kJ,根据热化学方程式书写原则进行书写;加入催化剂能降低反应所需的活化能,但是不改变反应物的总能量和生成物的总能量;
(2)①根据反应物的总能量、中间产物的总能量以及最终产物的总能量,结合化学方程式以及热化学方程式的书写方法解答;
②根据盖斯定律可知,反应无论一步完成还是分多步完成,生成相同的产物,反应热相等.
(2)①根据反应物的总能量、中间产物的总能量以及最终产物的总能量,结合化学方程式以及热化学方程式的书写方法解答;
②根据盖斯定律可知,反应无论一步完成还是分多步完成,生成相同的产物,反应热相等.
解答:
解:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1,
加入催化剂能降低反应所需的活化能,则E1和E2都减小,催化剂不能改变反应物的总能量和生成物的总能量之差,即反应热不改变,所以催化剂对反应热无影响,
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1;减小;减小;否;
(2)①由图象可知,1molP与Cl2反应生成1molPCl3放出306lJ的能量,
则反应的热化学方程式为P(s)+
Cl2(g)═PCl3(g)△H=-306kJ?mol-1,
由图象可知,1molPCl5分解成PCl3和Cl2需要吸收93kJ的能量,
则反应的热化学方程式为PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ?mol-1,
故答案为:P(s)+
Cl2(g)═PCl3(g)△H=-306kJ?mol-1;
②由图象可知,P和Cl2分两步反应生成1molPCl5的△H3=-306kJ/mol-(+93kJ/mol)=-399kJ/mol,根据盖斯定律可知,反应无论一步完成还是分多步完成,生成相同的产物,反应热相等,则P和Cl2一步反应生成1molPCl5的反应热等于P和Cl2分两步反应生成1molPCl5的反应热,
故答案为:等于.
加入催化剂能降低反应所需的活化能,则E1和E2都减小,催化剂不能改变反应物的总能量和生成物的总能量之差,即反应热不改变,所以催化剂对反应热无影响,
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1;减小;减小;否;
(2)①由图象可知,1molP与Cl2反应生成1molPCl3放出306lJ的能量,
则反应的热化学方程式为P(s)+
| 3 |
| 2 |
由图象可知,1molPCl5分解成PCl3和Cl2需要吸收93kJ的能量,
则反应的热化学方程式为PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ?mol-1,
故答案为:P(s)+
| 3 |
| 2 |
②由图象可知,P和Cl2分两步反应生成1molPCl5的△H3=-306kJ/mol-(+93kJ/mol)=-399kJ/mol,根据盖斯定律可知,反应无论一步完成还是分多步完成,生成相同的产物,反应热相等,则P和Cl2一步反应生成1molPCl5的反应热等于P和Cl2分两步反应生成1molPCl5的反应热,
故答案为:等于.
点评:本题考查热化学方程式的书写以及盖斯定律的应用,题目难度中等,注意正确理解并运用盖斯定律,注意热化学方程式的书写方法,注意催化剂对反应的影响.

练习册系列答案
相关题目
分类是科学研究的重要方法,下列物质属于电解质的是( )
| A、Cu |
| B、CO2 |
| C、冰醋酸 |
| D、氨水 |
下列说法正确的是( )
| A、已知20℃时,KNO3的溶解度为31.6g.则20℃时KNO3饱和溶液的质量分数等于31.6% |
| B、1mol/L的食盐溶液中含有58.5gNaCl |
| C、所有物质的溶解度随着温度的升高而上升 |
| D、实验室需要230mL 0.1mol/L的H2SO4溶液,应选用250mL容量瓶配制 |
下列各物质含有共价键的单质的是( )
| A、HCl |
| B、Cu |
| C、NH4Cl |
| D、H2 |
设NA表示阿伏加德罗常数值,下列叙述正确的是( )
| A、常温常压下,56 g Fe与足量的盐酸完全反应转移的电子数为3NA |
| B、标准状态下,11.2 L氯气含有分子数为0.5 NA |
| C、0.1 mol?L-1的硫酸铝溶液所含的SO42-数就是0.3NA |
| D、NA个He分子所具有的体积为22.4L |
下列物质属于纯净物的是( )
| A、氯化钠 | B、氨水 |
| C、漂白粉 | D、碘酒 |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、标准状况下,11.2 L Cl2通入含0.5molFeBr2的溶液中转移电子数为1.5NA |
| B、0.1 mol?L-1的AlCl3溶液与足量NaOH溶液反应所得产物中含AlO2-为0.1NA |
| C、足量Zn与浓硫酸共热可生成标准状况下的气体2.24 L,则参加反应的硫酸为0.4 NA |
| D、常温常压下,5.6g环丙烷和聚乙烯的混合物中含有的碳原子数为0.4NA |

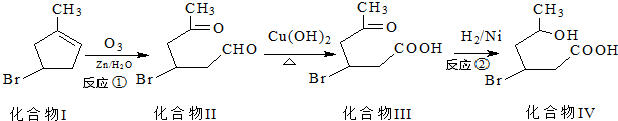
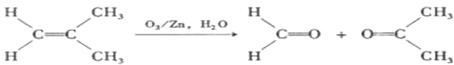
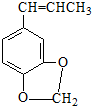 )发生类似反应①的反应,得到乙醛和化合物Y,Y的结构简式为
)发生类似反应①的反应,得到乙醛和化合物Y,Y的结构简式为